
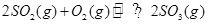 ����������ʼ�����ﵽ��ƽ�⡣��ʱSO2��O2�����ʵ���֮��Ϊ2��1������ȡij�ִ�ʩ������SO2��O2��������һЩ�����ٴδﵽƽ�⣬����˵����ȷ����
����������ʼ�����ﵽ��ƽ�⡣��ʱSO2��O2�����ʵ���֮��Ϊ2��1������ȡij�ִ�ʩ������SO2��O2��������һЩ�����ٴδﵽƽ�⣬����˵����ȷ���� | A����ƽ����ϵ�У�SO2��O2���ʵ���֮����Ϊ2��1 |
| B��ƽ��������Ӧ�����ƶ��ˣ�ԭ��������Ӧ���������ˣ��淴Ӧ���ʼ�С�� |
| C����ƽ����ϵ���ƽ����ϵ�Ƚϣ�SO3��Ũ�ȿ϶������� |
| D��������ȡ�Ĵ�ʩ����С�������ݻ�������ƽ��SO2��O2ת����֮�Ⱥ;�ƽ����SO2��O2��ת����֮�ȶ���1��1 |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C �Ѵ�ƽ��״̬�ĵ���
2C �Ѵ�ƽ��״̬�ĵ����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 Z(g)����60 s�ﵽƽ������0.3 mol��Z������˵����ȷ����
Z(g)����60 s�ﵽƽ������0.3 mol��Z������˵����ȷ����| A��60 sʱZ��ƽ��Ũ��Ϊ0.03 mol/L |
| B���������ݻ���Ϊ20 L��Z����ƽ��Ũ�Ƚ�����ԭƽ��Ũ�ȵ�һ�� |
| C�����¶Ⱥ�������䣬������������1 mol N2��ѹǿ����Y��ת���ʽ����� |
| D���������¶ȣ�X�������������������Ӧ�ġ�H>0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C��g��,���� 2 s���룩���� C ��Ũ��Ϊ 0.6 mol��L-1 �����м���˵���в���ȷ���ǣ�
2C��g��,���� 2 s���룩���� C ��Ũ��Ϊ 0.6 mol��L-1 �����м���˵���в���ȷ���ǣ�| A�������� A ��ʾ�ķ�Ӧ��ƽ������Ϊ 0.3 mol�M(l��s) |
| B�������� B ��ʾ�ķ�Ӧ��ƽ������Ϊ 0.3 mol�M(l��s) |
| C��2 s ʱ���� A ��ת����Ϊ30% |
| D��2 s ʱ���� B ��Ũ��Ϊ 0.7 mol�Ml |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ��
�� 2��(g)���ǹ�ҵ��������Ҫ��Ӧ֮һ��
2��(g)���ǹ�ҵ��������Ҫ��Ӧ֮һ��| �¶�/�� | 400 | 450 | 500 | 550 | 600 | 650 |
| ת����/% | 99.2 | 97.5 | 93.5 | 85.6 | 73.7 | 58.5 |
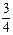 O2(g) ��
O2(g) �� 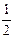 R2O3(s) ��H����834.8 kJ��mol��1
R2O3(s) ��H����834.8 kJ��mol��1�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 xC(g)��2D(g)����5 min���ƽ��״̬����ʱ���D��Ũ��Ϊ0.5 mol/L���������������Ϊ134.4 L����״������C��ƽ����Ӧ����Ϊ0.1 mol/(L��min)������
xC(g)��2D(g)����5 min���ƽ��״̬����ʱ���D��Ũ��Ϊ0.5 mol/L���������������Ϊ134.4 L����״������C��ƽ����Ӧ����Ϊ0.1 mol/(L��min)�������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A���ϳɰ���Ӧ��N2(g)+3H2(g) 2NH3(g) ����H<0��Ϊʹ���IJ�����ߣ�������Ӧ��ȡ���¸�ѹ�Ĵ�ʩ 2NH3(g) ����H<0��Ϊʹ���IJ�����ߣ�������Ӧ��ȡ���¸�ѹ�Ĵ�ʩ | |
B����2HI(g) H2(g)+I2(g)ƽ����ϵ����ѹǿʹ��ɫ���� H2(g)+I2(g)ƽ����ϵ����ѹǿʹ��ɫ���� | |
| C��ʹ�ô������������SO2��O2����SO3��Ч�� | D�����ű����Ȼ�����Һ�ķ������ռ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO��NH2��2��s��+H2O��g��
CO��NH2��2��s��+H2O��g��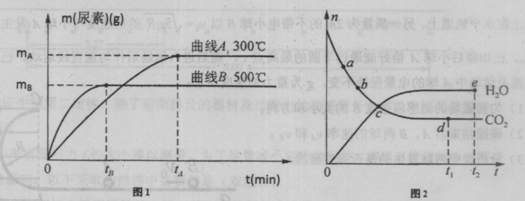
| A�����������ܶȲ��ٷ����ı� | B��ͼ2��C��ʱ���÷�Ӧ�ﵽ��ƽ��״̬ |
| C����������ѹǿ���ٷ����ı� | D����������2n mol NH3ʱ��ͬʱ������n molH2O |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com