ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常表现出+3价,含ⅢA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题.
(1)基态B原子核外电子排布式
,在BF
3分子中中心原子B的轨道杂化方式
.
(2)氯化铝(AlCl
3)为无色透明晶体或白色而微带浅黄色的结晶性粉末,密度2.44g/cm
3,熔点190℃(2.5大气压),沸点182.7℃,在177.8℃升华,氯化铝的蒸气或溶于非极性溶剂中或处于熔融状态时,都以共价的二聚成Al
2Cl
6形式存在,则氯化铝属于
晶体(填所属晶体类型)
(3)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其中10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措,砷化镓晶胞结构与金刚石相似.试回答下列问题:
①下列说法正确的是
(填序号).
A.砷化镓晶胞结构中Ga原子的轨道杂化方式为sp
3 B.第一电离能:As<Ga
C.电负性:As<GaD.砷和镓都属于p区元素
②砷化镓是将(CH
3)
3Ga和AsH
3用MOCVD方法制备得到,该反应在700℃进行,反应的方程式为
.
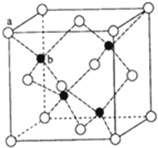
(4)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛.立方ZnS晶体结构如图所示,其晶胞边长为540.0pm,密度为
g/cm
3.(a为S
2-,b为Zn
2+)(阿伏加德罗常数:N
A?mol
-1)

 ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常表现出+3价,含ⅢA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题.
ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常表现出+3价,含ⅢA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题.

 春雨教育同步作文系列答案
春雨教育同步作文系列答案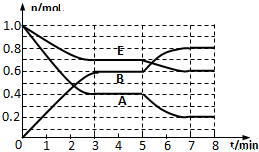 在一体积为2L的密闭容器中,气态物质A、B、E的物质的量n随时间t的变化如图所示.已知达到平衡后,降低温度A的转化率增大.
在一体积为2L的密闭容器中,气态物质A、B、E的物质的量n随时间t的变化如图所示.已知达到平衡后,降低温度A的转化率增大.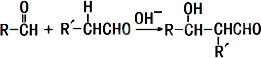
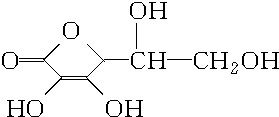 维生素C是一种水溶性维生素(其水溶液呈酸性),分子式为C6H8O6,结构如图所示.人体缺乏维生素C易得坏血病,所以维生素C又称抗坏血酸,维生素C易被空气中的氧气氧化.在新鲜的水果、蔬菜、乳制品中都含维生素C,如新鲜的橙汁中维生素C的含量在500mg?L-1左右.下列关于维生素C的叙述错误的是( )
维生素C是一种水溶性维生素(其水溶液呈酸性),分子式为C6H8O6,结构如图所示.人体缺乏维生素C易得坏血病,所以维生素C又称抗坏血酸,维生素C易被空气中的氧气氧化.在新鲜的水果、蔬菜、乳制品中都含维生素C,如新鲜的橙汁中维生素C的含量在500mg?L-1左右.下列关于维生素C的叙述错误的是( )