
| 实验编号 | 起始浓度/(mol?L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
| A、实验①反应后的溶液中:c(A-)>c(K+)>c(OH-)>c(H+) | ||
B、实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=
| ||
| C、实验②反应后的溶液中:c(A-)+c(HA)<0.1 mol/L | ||
| D、实验②反应后的溶液中:c(K+)+c(OH-)=c(H+)+c(A-) |
| Kw |
| 1×10-9 |


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A、氢化物的沸点为H2T<H2R |
| B、单质分别与稀盐酸反应的速率:L<Q |
| C、L、M和R为同周期元素 |
| D、L2+与R2-的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al3+、Na+、NO3-、Cl- |
| B、K+、Na+、Cl-、AlO2- |
| C、K+、Na+、Cl-、NO3- |
| D、K+、NH4+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3=2Na++CO32- |
| B、CuCl2=Cu+Cl2↑ |
| C、NaHCO3=Na++H++CO32- |
| D、Ba(OH)2=Ba+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
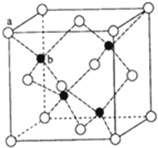 ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常表现出+3价,含ⅢA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题.
ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常表现出+3价,含ⅢA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
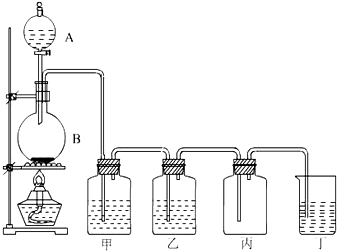 实验室制氯气的实验装置图如下所示:
实验室制氯气的实验装置图如下所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同碳原子数的醇分子中羟基数目越多,该物质就越易溶于水 |
B、乳酸 ( )分子中含有手性碳原子 )分子中含有手性碳原子 |
| C、白磷分子和甲烷分子均为正四面体,键角为109°28′ |
| D、H2CO3分子中的非羟基氧的个数为1,然而其酸性较弱,原因是溶于水的二氧化碳分子只有极少数与水结合成碳酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
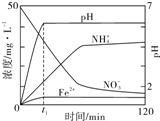 某课题组利用Fe粉和KNO3溶液反应,模拟地下水脱氮过程,探究脱氮原理.
某课题组利用Fe粉和KNO3溶液反应,模拟地下水脱氮过程,探究脱氮原理.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com