
����Ŀ�������������������������ٴ�����Ҫ���������Զ���Ӳ��������������һ�ֺϳ�·��������ʾ��

���������գ�
��1��д����Ӧ���ͣ���_______________ ��_______________��
��2��д����Ӧ�ڵĻ�ѧ����ʽ�� ___________________
��3����Ӧ������һ��Ӧ��F�Ľṹ��ʽΪ__________________��
��4������D�Ƿ��Ѿ���ȫת��E�IJ�����_________________________��
��5��д��һ��������������E��ͬ���칹��Ľṹ��ʽ��________________
i. �ܷ���ˮ�ⷴӦ ii. �����ϵ�һ�����ֻ������
��6������ͪ�� ���ǹ�ҵ�Ϻϳ�E��ԭ��֮һ�����һ���ɱ���ͪΪԭ�Ϻϳɾ۱���ϩ��
���ǹ�ҵ�Ϻϳ�E��ԭ��֮һ�����һ���ɱ���ͪΪԭ�Ϻϳɾ۱���ϩ�� ���ĺϳ�·�ߡ����ϳ�·�߳��õı�ʾ��ʽΪ��A
���ĺϳ�·�ߡ����ϳ�·�߳��õı�ʾ��ʽΪ��A![]() B
B ![]() ��______________________
��______________________
���𰸡� ȡ����Ӧ ȡ����Ӧ CH2ClCOOH+2NaOH![]() CH2OHCOONa+NaCl+H2O
CH2OHCOONa+NaCl+H2O 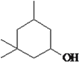 ȡ����������Ʒ�����ԣ������еμ�����Cu(OH)2����Һ����У�������ש��ɫ����˵��δ��ȫת������֮������ȫת��
ȡ����������Ʒ�����ԣ������еμ�����Cu(OH)2����Һ����У�������ש��ɫ����˵��δ��ȫת������֮������ȫת�� 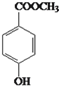 �Ⱥ�������
�Ⱥ������� 
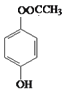
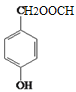
����������������������̿��ƶϣ�A�����ᣬA����������ȡ����Ӧ����B��BΪ�����ᣬB��ˮ�⡢�ữ�������ǻ����ᣬ�ǻ����ᾭ����������D��DΪ��ȩ�ᣬD�뱽�����ӳɷ�Ӧ����E��EΪ2-�ǻ�-2-�������ᣬE��F����������Ӧ������ȡ����Ӧ�����ɻ�����������FΪ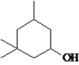 ��
��
��1����Ӧ���ͣ���ȡ����Ӧ����ȡ����Ӧ��
��2����Ӧ�ڵĻ�ѧ����ʽCH2ClCOOH+2NaOH![]() CH2OHCOONa+NaCl+H2O ��
CH2OHCOONa+NaCl+H2O ��
��3����Ӧ������һ��Ӧ��F�Ľṹ��ʽΪ ��
��
��4��DΪ��ȩ�ᣬ����D�Ƿ��Ѿ���ȫת��E�����Լ����л������Ƿ���ȩ�������������ȡ����������Ʒ�����ԣ������еμ�����Cu(OH)2����Һ����У�������ש��ɫ����˵��δ��ȫת������֮������ȫת����
��5��E��2-�ǻ�-2-������������ͬ���칹����������������i. �ܷ���ˮ�ⷴӦ��˵���������������� ii. �����ϵ�һ�����ֻ��������˵����������������Ϊ��λ��ȡ������������ͬ���칹���ж��֣���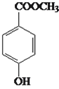 ��
�� ��
�� ����
����
��6���ɱ���ͪ�ϳɾ۱���ϩ��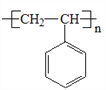 ���������ɱ���ͪ������ϳɣ�1-���Ҵ���Ȼ��1-���Ҵ�������ȥ��Ӧ�õ�����ϩ�������ϩ�Ӿۺϳɾ۱���ϩ������ϳ�·��������
���������ɱ���ͪ������ϳɣ�1-���Ҵ���Ȼ��1-���Ҵ�������ȥ��Ӧ�õ�����ϩ�������ϩ�Ӿۺϳɾ۱���ϩ������ϳ�·�������� 



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Ԫ���У�����ͬһ���ڵ���
A. Na��K B. Mg��O C. F��Cl D. Al��S
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��p��qΪֱ����Դ��������A�ɽ�������X�Ƴɣ�B��C��DΪ���缫����ͨ��Դ������X������B����ͬʱC��D�ϲ������ݣ��Իش� 
��1��pΪ����A����������Ӧ��
��2��CΪ�������ռ�����DΪ�������ռ��� ��
��3��C���ĵ缫��ӦʽΪ ��
��4���ڵ������У���C��D�����ϲ�������������ʵ�����������
ʱ�䣨min�� | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
������������������cm3�� | 6 | 12 | 20 | 29 | 39] | 49 | 59 | 69 | 79 | 89 |
������������������cm3�� | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
��ϸ��������ʵ�����ݣ���˵���仯�Ŀ���ԭ���� ��
��5������Ӧ����һ��ʱ���A��B�缫������Һ��pH���������С�����䡱����
��6������·��ͨ��0.004mol����ʱ��B���ϳ����Ľ���XΪ0.128g����˽�����Ħ������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ӦA2�� B2�� 2AB�������仯��ͼ��ʾ��������˵����ȷ����( )

A. �÷�Ӧ�����ȷ�Ӧ
B. ����1 mol A��A����1 mol B��B���ܷų�x kJ������
C. ����2 mol A��B����Ҫ����y kJ������
D. 2 mol AB������������1 mol A2��1 mol B2��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��W��X��Y��Z��ԭ���������ε�����a��b��c��d��e��f������ЩԪ����ɵĻ����dΪ���ӻ������ṹ�л����Ǽ��Թ��ۼ���mΪԪ��Y�ĵ��ʣ�ͨ��Ϊ��ɫ��ζ�����塣�������ʵ�ת����ϵ��ͼ��ʾ������˵����ȷ����

A. ԭ�Ӱ뾶:W<X<Y<Z
B. �����ӵĻ�ԭ�ԣ�Y>W
C. a������W��X����Ԫ�����
D. ͼ��ת������d��������Ϊ��Ӧ��ʱ����Ϊ���������ǻ�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ں������٣�������ά�������������������ز����ٵ�Ԫ���У� ��
A. Zn��Cu��B��Mn
B. Zn��Cu��Mg��Ca
C. Fe��Mn��Zn��Mg
D. Mg��Mn��Cu��Mo
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�ˮ��Һ�д��ڵ���ƽ�⣮
��1�������dz��������ᣮ �ٴ�����ˮ��Һ�еĵ��뷽��ʽΪ ��
�����з����У�����ʹ����ϡ��Һ��CH3COOH����̶��������������ĸ��ţ���
A���μ�����Ũ���� B������Һ
C����ˮϡ�� D���������������ƾ���
��2����0.1molL��1NaOH��Һ�ֱ�ζ������Ϊ20.00mL��Ũ�Ⱦ�Ϊ0.1molL��1������ʹ�����Һ���õ��ζ���������ҺpH�����NaOH��Һ������仯�������ζ����ߣ� 
�ٵζ���������������I������
�ڵζ���ʼǰ��������Һ����ˮ�������c��H+�������� ��
��V1��V2�Ĺ�ϵ��V1V2�����������=����������
��M���Ӧ����Һ�У������ӵ����ʵ���Ũ���ɴ�С��˳���� ��
��3��Ϊ���о������ܽ�ƽ��ͳ���ת����ijͬѧ�������ϲ��������ʵ�飮 ���ϣ�AgSCN�ǰ�ɫ��������ͬ�¶��£��ܽ�ȣ�AgSCN��AgI��
�������� | ���� |
����1����2mL 0.005molL��1 AgNO3��Һ�м���2mL 0.005molL��1 KSCN��Һ������ | ���ְ�ɫ���� |
����2��ȡ1mL�ϲ���Һ���Թ��У��μ�1��2molL��1 Fe��NO3��3��Һ | ��Һ���ɫ |
����3������2����Һ�У���������5��3molL��1 AgNO3��Һ | ����a�l�l�l����Һ��ɫ��dz |
����4������1���µ���Һ�м���5��3molL��1 KI��Һ | ���ֻ�ɫ���� |
��д������2����Һ���ɫ�����ӷ���ʽ ��
�ڲ���3������a�� ��
���û�ѧƽ��ԭ�����Ͳ���4��ʵ������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����бȽ�����ȷ����
A. ������Cl2>Br2 B. ��ԭ��Na>Mg
C. ����H2SO4>H3PO4 D. �ȶ���HBr>HCl
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com