
【题目】向100mL未知浓度的AlCl3和MgCl2的混合溶液中逐滴加入0.1 molL﹣1的NaOH溶液,生成沉淀的质量随加入NaOH溶液体积的变化关系如图所示,则AlCl3的浓度为( ) 
A.0.005 molL﹣1
B.0.01 molL﹣1
C.0.2 molL﹣1
D.0.1 molL﹣1
科目:高中化学 来源: 题型:
【题目】25 ℃时,在浓度均为1 mol·L-1的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的溶液中,测得其中c(NH![]() ) 分别为a,b,c(mol·L-1),则下列判断正确的是( )
) 分别为a,b,c(mol·L-1),则下列判断正确的是( )
A. c>a>b B. a>b>c C. b>a>c D. a>c>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】组成蛋白质的元素主要有C、H、O、N及S、P和少量的Zn、Cu等.
(1)N、P、S的第一电离能由小到大的顺序为 .
(2)组成蛋白质的最简单的氨基酸(HOOCCH2NH2)介子中,π键数目为 .
(3)Zn2+、Cu2+能与NH3、H2O、Cl﹣等形成配位数为4的配合物.①基态Zn2+的价电子(外围电子)排布式为 .
②[Zn(H2O)4]SO4中不存在的化学键类型有 . (填序号).
a.配位键 b.金属键 c.共价键 d.氢键 e.离子键
③[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl﹣取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 .
a.平面正方形 b.正四面体 c.三角锥形 d.V形
(4)由上述几种元素组成的6一氨基青霉烷酸的结构如图,其中采用sp3杂化的原子除了S外,还有 .
(5)紫外光的光子所具有的能量约为399kJmol﹣根据下表有关蛋白质分子中主要化学键的键能信息,说明人体长时间照射紫外光后皮肤易受伤害的原因是(填序号).
共价键 | C﹣C | C﹣N | C﹣S |
键能/(kJmol﹣1) | 347 | 305 | 259 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.向澄清石灰水中加入等物质的量的NaHCO3溶液:Ca2++2OH﹣+2HCO ![]() ═CaCO3↓+CO
═CaCO3↓+CO ![]() +2H2O
+2H2O
B.向NH4HSO4稀溶液中加入NaOH稀溶液少量:OH﹣+NH ![]() ═NH3?H2O
═NH3?H2O
C.氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O
D.向淀粉KI溶液中滴加酸性H2O2溶液,溶液变蓝色:H2O2+2I﹣+2H+═I2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是处理蚀刻电路板废液(含有FeCl2、FeCl3、CuCl2)回收FeCl3溶液的方案,下列有关说法正确的是( ) 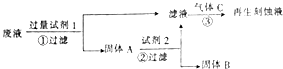
A.试剂1可以是铁也可以是铜
B.试剂2可以是盐酸也可以是硫酸
C.气体C为Cl2 , 不能用H2O2替换
D.步骤①②③中发生的反应均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物M的结构简式如下: ![]() 下列有关M的叙述中正确的是( )
下列有关M的叙述中正确的是( )
A.M的分子式为:C12H15O5N2
B.M可以发生水解反应、中和反应、加成反应、消去反应
C.M的水解产物中一定含有醇类
D.1 molM最多可以与1L4mol/L的NaOH溶液完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[Al2(SO4)318H2O].
I.实验室制取无色的无水AlBr3(熔点:97.5℃,沸点:263.3~265℃)可用如图所示装置,主要实验步骤如下:
步骤1:将铝箔剪碎,用CCl4浸泡片刻,干燥,然后投入到烧瓶6中.
步骤2:从导管口7导入干燥的氮气,同时打开导管口l和4放空,一段
时间后关闭导管口7和1;导管口4接装有P2O5的干燥管.
步骤3:从滴液漏斗滴入一定量的液溴于烧瓶6中,并保证烧瓶6
中铝过剩.
步骤4:加热烧瓶6,回流一定时间.
步骤5:将氮气的流动方向改为从导管口4到导管口1.将装有
P2O5的干燥管与导管口1连接,将烧瓶6加热至270℃左右,使溴化铝
蒸馏进入收集器2.
步骤6:蒸馏完毕时,在继续通入氮气的情况下,将收集器2从3处
拆下,并立即封闭3处.
(1)步骤1中,铝箔用CCl4浸泡的目的是 .
(2)步骤2操作中,通氮气的目的是 .
(3)步骤3中,该实验要保证烧瓶中铝箔过剩,其目的是 .
(4)步骤4依据何种现象判断可以停止回流操作 .
(5)步骤5需打开导管口1和4,并从4通入N2的目的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组欲通过实验方法验证Fe2+的某些性质.
(1)在实验前,依据Fe2+的性,填写了如表.
实验操作 | 预期现象 | 反应的离子方程式 |
向盛有新割FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO3﹣+2H+=Fe3++NO2↑+H2O |
依照表中操作,该小组进行实验.观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色.
(2)分别取少量反应后的溶液于两只试管中,一只滴加几滴KSCN溶液,溶液变为变红,则溶液中含有;另一只试管滴加几滴溶液,产生蓝色沉淀,则含有Fe2+ .
(3)该小组讨论认为深棕色可能是NO2或NO与铁的某一种离子发生反应引起的.
提出猜想:
ⅰ.NO2与Fe2+发生反应ⅱ.NO2 与Fe3+发生反应
ⅲ.NO与Fe2+发生反应ⅳ.
(4)该小组用如图装置进行探究: 
步骤 | 操作及现象 | 解释或结论 |
① | 关闭k、b,打开a,开始甲中反应,一段时间后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化 | 溶液深棕色由与NO或NO2反应而的得到 |
② | 停止甲中反应,打开k、b,关闭a,持续通入N2一段时间 | 该操作的目的 |
③ | 更换新的丙、丁装置,再通一段时间N2后关闭k,使甲中反应继续,观察到的现象与步骤①中相同 | 乙瓶中发生的化学反应方程式为 |
(5)结合实验猜想,得出结论:
溶液呈深棕色的原因:肯定成立的是猜想;不确定的是猜想 , 有待后续实验进一步探究.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com