
【题目】下列离子方程式正确的是( )
A.向澄清石灰水中加入等物质的量的NaHCO3溶液:Ca2++2OH﹣+2HCO ![]() ═CaCO3↓+CO
═CaCO3↓+CO ![]() +2H2O
+2H2O
B.向NH4HSO4稀溶液中加入NaOH稀溶液少量:OH﹣+NH ![]() ═NH3?H2O
═NH3?H2O
C.氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O
D.向淀粉KI溶液中滴加酸性H2O2溶液,溶液变蓝色:H2O2+2I﹣+2H+═I2+2H2O
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】有一无色未知溶液中检验出有Ba2+、Ag+ , 同时又测得其酸性很强.某学生还要鉴定此溶液中是否大量存在①Cu2+ ②Al3+ ③Cl﹣ ④NO ![]() ⑤NH4+ ⑥CO
⑤NH4+ ⑥CO ![]() ⑦S2﹣ ⑧Mg2+ ⑨Fe3+ , 而事实上有部分离子不用鉴定就能加以否定,你认为不必鉴定的是( )
⑦S2﹣ ⑧Mg2+ ⑨Fe3+ , 而事实上有部分离子不用鉴定就能加以否定,你认为不必鉴定的是( )
A.③⑤⑥⑦⑨
B.①③⑥⑦⑨
C.③④⑦⑧⑨
D.①②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次递增的甲、乙、丙、丁、戊是周期表中前30号元素,其中甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2;丁与戊原子序数相差18,戊元素是周期表中ds区的第一种元素。回答下列问题:
(1)甲能形成多种常见单质,在熔点很高的两种常见单质中,原子的杂化方式分别为______、__________。
(2)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测丁元素的电离能突增应出现在第________电离能。
(3)戊的基态原子有________种形状不同的原子轨道;
(4)甲、乙分别都能与丙形成原子个数比为 1:3的微粒,则该两种微粒的空间构型分别为:_________________ ;__________________。
(5)丙和丁形成的一种离子化合物的晶胞结构如右图,该晶体中阳离子的配位数为_________ 。距一个阴离子周围最近的所有阳离子为顶点构成的几何体为_______________。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,该化合物的相对分子质量为 M,则该晶胞中黑球的半径r =_____cm。(用含ρ、NA的计算式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】共聚法可改进有机高分子化合物的性质,高分子聚合物P的合成路线如下: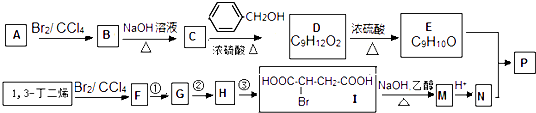
(1)B的名称为 , E中所含官能团的名称为 .
(2)F可以使溴水褪色,其中②的反应试剂是 , ③的反应类型是 .
(3)下列说法正确的是(填字母序号).a.C可与水任意比例混合
b.A与1,3一丁二烯互为同系物
c.由I生成M,1mol最多消耗3mol NaOH
d.N不存在顺反异构体
(4)写出E与N按照物质的量之比为1:1发坐共聚生成P的化学反应方程式: , 高聚物P的亲水性比由E形成的聚合物(填“强”或“弱”).
(5)D的同系物K比D分子少一个碳原子,K有多种同分异构体,符合下列条件的K的同分异构体有种,写出其中核磁共振氢谱为1:2:2:2:3的一种同分异构体的结构简式: . a.苯环上有两种等效氢
b.能与氢氧化钠溶液反应
c.一定条件下1mol该有机物与足量金属钠充分反应,生成1mol H2 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、钠混合物投入足量的水中,充分反应后,得到澄清溶液,并收集到4.48L H2(标准状况),若钠的物质的量为0.1mol,则铝的物质的量为( )
A.0.1 mol
B.0.2 mol
C.0.05 mol
D.0.025 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL未知浓度的AlCl3和MgCl2的混合溶液中逐滴加入0.1 molL﹣1的NaOH溶液,生成沉淀的质量随加入NaOH溶液体积的变化关系如图所示,则AlCl3的浓度为( ) 
A.0.005 molL﹣1
B.0.01 molL﹣1
C.0.2 molL﹣1
D.0.1 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究自正确的理论指导,合成氨反应N2+3H2![]() 2NH3的平衡常数K值和温度的关系如下:
2NH3的平衡常数K值和温度的关系如下:
温度/℃ | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①由表中数据可知该反应为______反应(填“放热”或“吸热”)
②理论上,为了增大平衡时H2的转化率,可采取的措施是______________(填字母序号)。
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应CH4(g)+H2O(g) ![]() CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的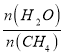 恒定时,温度、压强对平衡混合气中CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气中CH4含量的影响如图所示:

①图中,两条曲线表示压强的关系是p1________p2(填“>”、“=”或“<”)。
②该反应为________反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CO(g)+H2O(g) ![]() CO2(g)+H2(g)获取。T ℃时,向容积固定为2 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO2的浓度为0.3 mol·L-1,则平衡时CO的转化率为________
CO2(g)+H2(g)获取。T ℃时,向容积固定为2 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO2的浓度为0.3 mol·L-1,则平衡时CO的转化率为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000molL﹣1盐酸滴入20.00mL 1.000molL﹣1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( ) 
A.a点由水电离出的c(H+)=1.0×10﹣14molL﹣1
B.b点:c(NH4+)+c(NH3H2O)=c(Cl﹣)
C.c点:c(Cl﹣)=c(NH4+)
D.d点后,溶液温度略下降的主要原因是NH3H2O电离吸热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com