
【题目】在 1.0 L 密闭容器中放入 0.10molA(g),在一定温度进行如下反应:A(g)![]() 2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1。容器内气体总压强(P)与起始压强 P0 的比值随反应时间(t)数据见下表:
2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1。容器内气体总压强(P)与起始压强 P0 的比值随反应时间(t)数据见下表:
时间 t/ h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
P /P0 | 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
回答下列问题:
(1)该平衡常数的表达式为_____________。
(2)下列能提高 A 的转化率的是________。
A.升高温度 B.体系中通入 A 气体 C.将 D 的浓度减小
D.通入稀有气体 He,使体系压强增大到原来的 5 倍
E.若体系中的 C 为 HCl,其它物质均难溶于水,滴入少许水
(3)前 2小时 C 的反应速率是___________ mol.L-1.h-1;
(4)平衡时 A 的转化率___________ C 的体积分数_________(均保留两位有效数字)
【答案】 K=![]() A E 0.02mol.L-1.h-1 70% 29%
A E 0.02mol.L-1.h-1 70% 29%
【解析】(1)反应A(g)![]() 2B(g)+C(g)+D(s)的平衡常数的表达式为K=
2B(g)+C(g)+D(s)的平衡常数的表达式为K=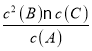 ;(2)A.升高温度,平衡正向移动,所以A的转化率增大,选项A正确;B.体系中通入A气体,A的转化率减小,选项B错误;C.将D(固体)的浓度减小,不会引起平衡的移动,A的转化率不变,选项C错误;D.通入稀有气体He,使体系压强增大到原来的5倍,但是各组分浓度不变,不会引起平衡的移动,A的转化率不变,选项D错误;E.若体系中的C为HCl,其它物质均难溶于水,滴入少许水,则压强减小,平衡正向移动,所以A的转化率增大,选项E正确;答案选AE;
;(2)A.升高温度,平衡正向移动,所以A的转化率增大,选项A正确;B.体系中通入A气体,A的转化率减小,选项B错误;C.将D(固体)的浓度减小,不会引起平衡的移动,A的转化率不变,选项C错误;D.通入稀有气体He,使体系压强增大到原来的5倍,但是各组分浓度不变,不会引起平衡的移动,A的转化率不变,选项D错误;E.若体系中的C为HCl,其它物质均难溶于水,滴入少许水,则压强减小,平衡正向移动,所以A的转化率增大,选项E正确;答案选AE;
(3)在1.0L密闭容器中放入0.10mol A(g),设A的变化量是x,则
A(g)2B(g)+C(g)+D(s)
初始量:0.1 0 0
变化量:x 2x x
末态量:0.1-x 2x x
则![]() =
=![]() ,解得x=0.04mol,所以前2小时A的反应速率是v=
,解得x=0.04mol,所以前2小时A的反应速率是v=![]() =
= =0.02mol.L-1.h-1,物质表示的反应速率之比等于系数之比,所以C表示的反应速率为:0.02 mol.L-1.h-1;
=0.02mol.L-1.h-1,物质表示的反应速率之比等于系数之比,所以C表示的反应速率为:0.02 mol.L-1.h-1;
(4)设:平衡时A的变化量是y,
A(g)2B(g)+C(g)+D(s)
初始量:0.1 0 0
变化量:y 2y y
平衡量:0.1-y 2y y
化学反应在20h时建立平衡,所以![]() =2.4,解得y=0.07mol,所以平衡时A的转化率=
=2.4,解得y=0.07mol,所以平衡时A的转化率=![]() ×100%=70%,C的体积分数=
×100%=70%,C的体积分数=![]() ×100%=
×100%=![]() ×100%=
×100%=![]() ×100%=29%。
×100%=29%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的自然科学,用下列各装置或其组合能完成相应实验的是(已知实验室可用块状硫化亚铁(FeS)与稀硫酸反应制取硫化氢(H2S)气体)

A. 装置②⑦可用于制取并收集干燥的CO2
B. 装置①⑤可用于制取并收集氧气
C. 装置②⑥可用于制取并收集硫化氢(H2S)气体
D. 装置④装满水后可以收集并储存氧气,需要氧气时可用水将装置中的氧气排出,水应从b端通入
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在生产、生活和科技等方面都有着重要的应用。回答下列问题:
(1)已知:①2I2(s)+5O2(g)=2I2O5(s) ΔH=—1966 kJmol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=—1200 kJmol-1 。
则5CO(g)+I2O5(s)=5CO2(g)+I2(s)的△H= __________________________。
(2)碘不易溶于水,但易溶于碘化钾溶液并生成多碘离子,反应如下:
① I2(s)+I-(aq)![]() I3-(aq) △H<0; ② I2 (s)+2I-(aq)
I3-(aq) △H<0; ② I2 (s)+2I-(aq)![]() I42-(aq)。
I42-(aq)。
温度降低时,反应①的平衡常数将______________(填“增大”“减小”或“不变”);反应②的平衡常数的表达式为K=__________________________。
(3)碘与钨在一定温度下,可发生如下可逆反应:W(s)+I2(g)![]() WI2(g)。现准确称取0.508g碘和0.736g金属钨放置于50.0mL的密闭容器中,并加热使其反应。如图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
WI2(g)。现准确称取0.508g碘和0.736g金属钨放置于50.0mL的密闭容器中,并加热使其反应。如图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。

① 该反应△H____________0(填“>”或“<”)。
② 反应从开始到t1(t1= 3 min)时间内 I2 的平均反应速率v(I2)=_________。
③ 在450℃时,该反应的平衡常数K的值为__________________。
④ 能够说明上述反应已经达到平衡状态的有________________ (填选项字母)。
A.I2与WI2的浓度相等 B. 容器内各气体的浓度不再改变
C. 容器内混合气体的密度不再改变 D.容器内气体压强不发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家合成了一种新型除草剂的合成路线如下:

(1)① 中两种含氧官能团的名称_______、_____。除草剂⑦的分子式为_______ 。
(2)③与⑥生成⑦的反应类型是____,④⑤转化中另外一种产物是HCl,则试剂X是_____ 。
(3)写出一种同时满足下列条件的物质③的同分异构体的结构简式______________。
① 属于芳香族化合物; ② 苯环上的一取代物只有两种;
③ 在铜催化下与O2反应,其生成物1 mol与足量的银氨溶液反应生成4 mol Ag
(4)写出②③的化学方程式__________________________________________。
(5)卡巴拉丁是老年人认知障碍的重要治疗药物。请结合上述合成路线及下面所给的反应:![]()
ROH+SOCl2RCl+HOSOCl
请写出合成卡巴拉丁流程中A、B、D的结构简式,C试剂的化学式。

A:____________、B:_____________、C:____________、D:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G为7种短周期主族元素,其原子序数依次增大。A、C可形成A2C和A2C2两种化合物,B的最高正化合价与最低负化合价的绝对值之差为2,D和A同主族,E是地壳中含量最高的金属元素,F和C同主族且可形成FC2和FC3两种化合物。
(1)G的元素名称是__________,它在元素周期表中的位置是______________。
(2)F的质子数和中子数相等,F的原子组成符号为______,它的最高价为____价。
(3)C、D可形成一种淡黄色固体化合物,写出此化合物的电子式__________。
(4)由上述7种元素中的4种元素组成的化合物X,X既能与热的NaOH溶液反应,也能与稀盐酸反应,且均能生成无色气体,X的化学式是____________________。
(5)已知Se在第四周期,与S同主族,请任意写出一种含Se物质的化学式,预测其性质,并说明预测依据_______。
含Se物质化学式 | 性质 | 预测依据 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列常见的化合物的溶液中滴入足量氨水,最后不生成沉淀的是( )
A. AlCl3溶液
B. FeCl3溶液
C. MgSO4溶液
D. CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有A、B、C、D、E、F六种装置,如图所示。(胶塞、导管可自由选用)


(1)写出①~④的仪器名称:①__________,②__________,③________,④________。
(2)实验室制取并收集氧气时应选择________和________相连接,制取并收集氢气时应选择________和________相连接。
(3)做木炭还原氧化铜并检验生成气体的实验,应选择________和________相连接,检验气体时观察到的实验现象是__________________________________________________。
(4)制取氢气并做还原氧化铜的实验,应选择________和________装置,实验结束时应先停止加热,待试管冷却后,再停止通氢气,其原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2molO3和3molO2的质量之比为________,分子数之比为________,同温同压下的密度之比为________。
(2)在标准状况下,由CO和CO2组成的混合气体6.72L,质量为12g,此混合物中CO和CO2物质的量之比是____,混合气体的平均相对分子质量是_____,对氢气的相对密度是____。
(3)19 gACl2中含有0.4 mol Cl-,则该氯化物的摩尔质量是_____;A的相对原子质量是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,加入3mo1A和1molB,一定条件下发生反应3A(g)+B(g)![]() 2C(g)+D(g),达平衡时,测得C的浓度为wmol·L-1,若保持容器中容积和温度不变,重新按下列配比作起始物质,达到平衡时,C的浓度仍然为wmol·L-1的是
2C(g)+D(g),达平衡时,测得C的浓度为wmol·L-1,若保持容器中容积和温度不变,重新按下列配比作起始物质,达到平衡时,C的浓度仍然为wmol·L-1的是
A. 6molA+2molB B. 1.5molA-0.5molB+1molC+0.5molD
C. 3molA+1molB+2molC+1molD D. 1molB+2molC+1molD
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com