
【题目】由烃的衍生物A和芳香烃E 制备香精的重要原料M 的一种合成路线如下:

已知:
 (R1、R2表示烃基或H 原子)
(R1、R2表示烃基或H 原子)
![]()
请回答下列题:
(1)A的化学名称为__________________,B 的结构简式为____________________。
(2)C 中官能团的名称为__________________。D 分子中最多有__________个原子共平面。
(3)E→F的反应类型为___________________。D+G→M 的化学方程式为____________。
(4)同时满足下列条件的D 的同分异构体有____种(不考虑立体异构),其中核磁共振氢谱有3 组峰的结构简式为__________________。
①能发生水解反应和银镜反应; ②不含环状结构
(5)参照上述合成路线和信息。以![]() 为原料(其他无机试剂任选),设计制备
为原料(其他无机试剂任选),设计制备 的合成路线_____________________。
的合成路线_____________________。
【答案】 2-丁醇 ![]() 羟基、羧基 11 加成反应
羟基、羧基 11 加成反应 ![]() 8
8 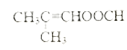

【解析】根据已知: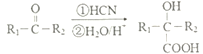 ,B转化为C,C发生消去反应,由
,B转化为C,C发生消去反应,由![]() 推出C中羟基在羧基相连的碳上,则C为
推出C中羟基在羧基相连的碳上,则C为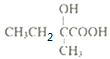 ,B为
,B为![]() ,A催化氧化得到B,则B为2-丁醇;由已知
,A催化氧化得到B,则B为2-丁醇;由已知![]() 可推知E为苯乙烯,苯乙烯反应生成F为
可推知E为苯乙烯,苯乙烯反应生成F为![]() ,
,![]() 在氢氧化钠的水溶液中加热发生取代反应生成G为
在氢氧化钠的水溶液中加热发生取代反应生成G为![]() ,
,![]() 与
与![]() 发生酯化反应(取代反应)生成M为
发生酯化反应(取代反应)生成M为![]() 。(1)A的化学名称为2-丁醇,B的结构简式为
。(1)A的化学名称为2-丁醇,B的结构简式为![]() ;(2)C为
;(2)C为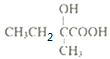 ,官能团的名称为羟基、羧基;D为
,官能团的名称为羟基、羧基;D为![]() ,根据乙烯分子中6个原子共平面,羧基中至少4个原子共平面,故分子中最多有11个原子共平面;(3)E→F是苯乙烯在过氧化氢作用下与氯化氢发生加成反应生成
,根据乙烯分子中6个原子共平面,羧基中至少4个原子共平面,故分子中最多有11个原子共平面;(3)E→F是苯乙烯在过氧化氢作用下与氯化氢发生加成反应生成![]() ,反应类型为加成反应;D+G→M是
,反应类型为加成反应;D+G→M是![]() 与
与![]() 发生酯化反应(取代反应)生成
发生酯化反应(取代反应)生成![]() 和水,化学方程式为
和水,化学方程式为![]() ;(4)D(
;(4)D(![]() )的同分异构体,满足:①能发生水解反应和银镜反应,由于只有两个氧故只能是甲酸酯,②不含环状结构,则应该还含有一个碳碳双键,满足条件的同分异构体有HCOOCH=CHCH2CH3、HCOOCH2CH=CHCH3、HCOOCH2CH2CH=CH2、HCOOCH2C(CH3)=CH2、HCOOC=CH(CH3)2、HCOOC=CH2(CH2CH3)、HCOOC(CH3)=CH2CH3、HCOOCH(CH3)CH=CH2共8种;核磁共振氢谱有3组峰的结构简式为
)的同分异构体,满足:①能发生水解反应和银镜反应,由于只有两个氧故只能是甲酸酯,②不含环状结构,则应该还含有一个碳碳双键,满足条件的同分异构体有HCOOCH=CHCH2CH3、HCOOCH2CH=CHCH3、HCOOCH2CH2CH=CH2、HCOOCH2C(CH3)=CH2、HCOOC=CH(CH3)2、HCOOC=CH2(CH2CH3)、HCOOC(CH3)=CH2CH3、HCOOCH(CH3)CH=CH2共8种;核磁共振氢谱有3组峰的结构简式为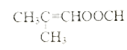 ;(5)参照上述合成路线和信息。
;(5)参照上述合成路线和信息。![]() 与HCN反应后酸化得到
与HCN反应后酸化得到![]() ,
,![]() 发生消去反应得到
发生消去反应得到![]() ,
,![]() 在一定条件下发生加聚反应生成
在一定条件下发生加聚反应生成 ![]() ,合成路线如下
,合成路线如下 。
。


科目:高中化学 来源: 题型:
【题目】实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:

下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
i. CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
ii. CO(g)+2H2(g)![]() CH3OH(g) △H2
CH3OH(g) △H2
iii. CO2(g)+H2(g)![]() CO (g)+H2O(g) △H3
CO (g)+H2O(g) △H3
回答下列问题:
(1)已知反应ii中的相关的化学键键能(“C![]() O”表示CO的化学键)数据见表:
O”表示CO的化学键)数据见表:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H2=______________。
(2)反应i、ii、iii对应的平衡常数K1、K2、K3之间的关系式为_______________
(3)一定条件下,在2L的恒容密闭容器中充入1molCO2和2molH2发生反应i 。下图是反应体系中CO2的平衡转化率与温度的关系曲线。

①△H1_____0(填“大于”或“小于”)
②当温度为500K时,该反应10min达到平衡。0~10min时间内用CH3OH表示该反
应的化学反应速率为_____________________。
③若改充入1mol CO2和3mol H2,则图中的曲线会_________(填“上移”或“下移”)。
(4)在3 L容积可变的密闭容器中发生反应iii,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是______;当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_______。

(5)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池。以此电池作电源,在实验室中模拟铝制品表面“钝化”处理过程(装置如图所示)。其中物质b是__________, 阳极电极反应为_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一铁粉和氧化铜的混合物8.32g,进行如下实验:

根据实验所得数据,有关说法正确的是
A. 无色气体的质量为0.2g
B. 原混合物中铁的质量为7.0g
C. 反应后的溶液中金属离子物质的量为0.1mol
D. 反应消耗的H2SO4物质的量为0.15mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线图(纵坐标为沉淀的量,横坐标为加入物质的量)与对应的选项相符合的是( )


A.向1 L浓度均为0.1 mol·L-1的Ba(OH)2、NaAlO2混合溶液中加入0.1 mol·L-1的稀H2SO4
B.向1 L浓度分别为0.1 mol·L-1和0.3 mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol·L-1的稀NaOH溶液
C.向烧碱溶液中滴加明矾溶液
D.向AlCl3溶液中滴加过量氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时H2S饱和液浓度为0.1 mol·L-1,电离方程式为H2S ![]() H++HS-,HS-
H++HS-,HS-![]() H++S2-,若要使该溶液H+浓度增大,同时使S2-浓度减小,可采取的措施是
H++S2-,若要使该溶液H+浓度增大,同时使S2-浓度减小,可采取的措施是
A. 加入少量的水 B. 加入少量的NaOH固体
C. 通入少量的SO2 D. 加入少量的CuSO4固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用相关原理,回答问题:
Ⅰ.(1)25℃时,水的离子积Kw值为____________。
(2)在T℃的水溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L,x与y的关系如图所示:

①T℃下,水的离子积为_______________。
②T℃下,0.01 mol/L NaOH溶液中c(H+) 为____________mol/L。
Ⅱ.25℃时,电离平衡常数如下。回答下列问题:
化学式 | CH3COOH | H2S | HClO |
电离平衡常数 | 1.8×10-5 | K1=1.3×10-7 K2=7.1×10-15 | 3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的下列四种物质:
a.Na2S b.NaClO c.CH3COONa d.NaHS
pH由大到小的顺序是____________________(填序号)。
(2)25℃时,0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是___________________。
a.c(H+) b.c(H+)/c(CH3COOH) c.c(H+)·c(OH-)
(3)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中 c(CH3COO-)-c(Na+)=______________mol/L(填数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol/L的KI溶液和0.05mol/LFe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I-![]() 2Fe2++I2”的是
2Fe2++I2”的是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A. ①和② B. ②和④ C. ③和④ D. ①和③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上最大的钨储藏国。金属钨可用于制造灯丝、超硬模具和光学仪器。在工业上常采用高温还原WO3法制取金属钨。回答下列问题:
(1)白钨矿(主要成分是CaWO4)与盐酸反应生成沉淀,灼烧沉淀即可得到WO3,上述两步反应的化学方程式为_________________、__________________。
(2)T℃时,WO3经如下的四步反应生成W。每一步反应的焓变和平衡常数如下: WO3(s)+0.1H2(g)![]() WO2.9(s)+0.1H2O(g) △H1 K1
WO2.9(s)+0.1H2O(g) △H1 K1
WO2.9(s)+0.18H2(g)![]() WO2.72(s)+0.18H2O(g) △H2 K2
WO2.72(s)+0.18H2O(g) △H2 K2
WO2.72(s)+0.72H2(g)![]() WO2(s)+0.72H2O(g) △H3 K3
WO2(s)+0.72H2O(g) △H3 K3
WO2(s)+2H2(g)![]() W(s)+2H2O(g) △H4 K4
W(s)+2H2O(g) △H4 K4
则该温度下,WO3(s)+3H2(g)![]() W(s)+3H2O(g) △H=_________,K=__________。
W(s)+3H2O(g) △H=_________,K=__________。
(3)T1℃时,将一定质量WO3和8.0gH2置于2L密闭容器中,发生反应: WO3(s)+3H2(g)![]() W(s)+3H2O(g),混合气体各组分物质的量之比随时间变化的关系如图所示:
W(s)+3H2O(g),混合气体各组分物质的量之比随时间变化的关系如图所示:

①T1℃时,H2的平衡转化率a=_________%,反应平衡常数K=__________。
②若在4min时降低并维持温度为T2℃,则该反应的△H_______0,若在8min时缩小容器容积,则![]() _________1.3。(填“>”“ <”或“=”)
_________1.3。(填“>”“ <”或“=”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com