
硼元素在化学中有很重要的地位。硼的化合物在农业、医药等方面用途很广。请回答下列问题:
(1)写出与B元素同主族的Ga元素的基态原子核外电子排布式________________________________________________________________________。
从原子结构的角度分析,B、N、O元素的第一电离能由大到小的顺序为________。
(2)立方氮化硼可利用人工方法在高温高压条件下合成,属于超硬材料。同属原子晶体的氮化硼(BN)比晶体硅具有更高硬度和耐热性的原因是________________________________________________________________________________________________________________________________________________。
(3)在BF3分子中中心原子的杂化轨道类型是________,SiF4粒子的空间构型是________。又知若有d轨道参与杂化,能大大提高中心原子成键能力。试解释为什么BF3、SiF4水解的产物中,除了相应的酸外,前者生成BF4-后者却是生成SiF62-:________________________________________________________________________
________________________________________________________________________。
(4)科学家发现硼化镁在39 K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图是该晶体微观空间中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据图示确定硼化镁的化学式为________。
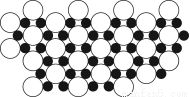
(1)1s22s22p63s23p63d104s24p1 N>O>B
(2)B—N键长比Si—Si短(或B—N键能较大)
(3)sp2杂化 正四面体 B原子最外电子层为L层,无d轨道;而Si原子最外层为M层,有d轨道,可参与杂化,使Si配位数增加至6
(4)MgB2
【解析】(1)氮元素的2p轨道为半充满状态,较稳定,所以第一电离能比氧元素的大。(2)原子晶体中,共价键键长越短,键能越大,则硬度和耐热性越强。(3)中心原子杂化轨道数=σ键个数+孤电子对数,BF3分子的中心原子含有3个σ 键,没有孤电子对,杂化轨道数为3,采取sp2杂化;SiF4分子的中心原子含有4个σ 键,没有孤电子对,杂化轨道数为4,采取sp3杂化,空间构型为正四面体形;Si原子最外电子层含有d轨道,而B原子最外电子层不含d轨道。(4)由图可知,硼化镁晶体的晶胞结构为 ,其中边缘上的Mg原子属于三个晶胞所有,故一个晶胞中含有3个Mg原子和6个B原子,则晶体中Mg原子和B原子个数比为1∶2。
,其中边缘上的Mg原子属于三个晶胞所有,故一个晶胞中含有3个Mg原子和6个B原子,则晶体中Mg原子和B原子个数比为1∶2。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷A(解析版) 题型:选择题
25 ℃时,水的电离达到平衡:H2O H++OH-,下列叙述正确的是( )
H++OH-,下列叙述正确的是( )
A.将纯水加热到95 ℃时,KW变大,pH不变,水仍呈中性
B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,KW变小
C.向纯水中加入少量固体碳酸钠,c(H+)减小,KW不变,促进水的电离平衡
D.向纯水中加入醋酸钠或盐酸,均可抑制水的电离,KW不变
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题5化学反应中的能量变化练习卷(解析版) 题型:选择题
在25 ℃、101 kPa时,CH4(g)、H2(g)、C(s)的燃烧热分别是-890.3 kJ·mol-1、-285.8 kJ·mol-1和-393.5 kJ·mol-1,则CH4(g)―→C(s)+2H2(g)的ΔH是( )
A.-74.8 kJ·mol-1 B.+74.8 kJ·mol-1
C.-211.0 kJ·mol-1 D.+211.0 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题4离子反应练习卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.能溶解Al2O3的溶液:Na+、K+、HCO3—、NO3—
B.0.1 mol·L-1Ca(ClO)2溶液:K+、Na+、I-、Cl-
C.能使甲基橙显红色的溶液:K+、Fe2+、Cl-、NO3—
D.加入KSCN显红色的溶液:Na+、Mg2+、Cl-、SO42—
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题17有机化学基础练习卷(解析版) 题型:填空题
对乙酰氨基苯酚F(CH3C—NHOOH)是常用的非甾类消炎解热镇痛药。F可用如下路线来合成:
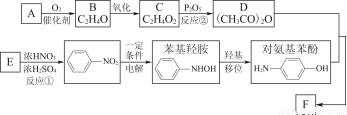
(1)若A分子的核磁共振氢谱只有一个吸收峰,且能使溴水褪色,则A的结构简式为 。
(2)反应①的反应类型是 ,反应②的反应类型是 。
(3)F的同分异构体有多种,写出两种满足下列条件的F的同分异构体的结构简式。
①苯环上有两个取代基;
②苯环上的一卤代物只有两种;
③能发生水解反应,水解产物之一遇FeCl3溶液显色。
、 。
(4)F在NaOH溶液中水解的化学方程式为 。
(5)D的同分异构体W结构简式为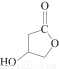 。下列关于W的说法正确的是( )
。下列关于W的说法正确的是( )
a.可与HBr反应生成溴代物
b.可发生消去反应,消去产物有两种
c.1 mol发生催化氧化反应后的产物可与2 mol H2发生加成反应
d.常温下可与Na2CO3溶液反应
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题16物质结构与性质练习卷(解析版) 题型:选择题
下列叙述不正确的是( )
A.金刚石、碳化硅、晶体硅的熔点依次降低
B.CaO晶体结构与NaCl晶体结构相似,每个CaO晶胞中含有4个Ca2+和4个O2-
C.设NaCl的摩尔质量为M g·mol-1,NaCl的密度为ρ g·cm-3,阿伏加德罗常数为NA mol-1,在NaCl晶体中,两个距离最近的Cl-中心间的距离为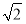 ·
·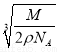 cm
cm
D.X、Y可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角位置,则该晶体的组成式为XY3
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题15化学与技术练习卷(解析版) 题型:填空题
请回答下列化工生产中的一些问题:
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在 的郊区(填标号)。
A.有丰富黄铁矿资源的城市
B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市
D.人口稠密的文化、商业中心城市
(2)CuFeS2 是黄铁矿的另一成分,煅烧时CuFeS2转化为CuO、Fe2O3 和SO2,该反应的化学方程式为 。
(3)为提高SO3吸收率,实际生产中通常用 吸收SO3。
(4)已知反应2SO2(g)+O2(g) 2SO3(g) ΔH <0,现将0.050 mol SO2和0.030 mol O2充入容积为1 L的密闭容器中,反应在一定条件下达到平衡,测得反应后容器压强缩小到原来压强的75%,则该条件下SO2的转化率为 ;该条件下的平衡常数为 。
2SO3(g) ΔH <0,现将0.050 mol SO2和0.030 mol O2充入容积为1 L的密闭容器中,反应在一定条件下达到平衡,测得反应后容器压强缩小到原来压强的75%,则该条件下SO2的转化率为 ;该条件下的平衡常数为 。
(5)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3 在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
沸腾炉温度/℃ | 600 | 620 | 640 |
炉渣中CuSO4的质量数/% | 9.3 | 9.2 | 9.0 |
已知CuSO4 在低于660 ℃时不会分解,请简要分析上表中CuSO4 的质量分数随温度升高而降低的原因 。
(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方法可用 (填名称)吸收,然后再用硫酸处理,重新生成SO2和一种生产水泥的辅料,写出这两步反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题14综合实验与探究练习卷A(解析版) 题型:选择题
下列化学实验事实及其解释都正确的是( )
①向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
②向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸
③向0.1 mol/L FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有氧化性
④向2.0 mL浓度均为0.1 mol/L的KCl、KI混合溶液中滴加1~2滴0.01 mol/L AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp大
A.①② B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题11金属元素单质及化合物练习卷(解析版) 题型:选择题
Al、Cu都是重要的金属元素。下列说法正确的是( )
A.两者对应的氧化物均为碱性氧化物
B.两者的单质都能与稀硫酸反应产生氢气
C.常温条件下,两种金属都能溶解于浓硝酸中
D.制备AlCl3、CuCl2,均不能采用将其溶液直接蒸干的方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com