
【题目】海水中有取之不尽的化学资源,从海水中可提取多种化工原料。下图是某工厂对海水资源的综合利用的示意图。

试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO![]() 等杂质,精制后可得NaCl饱和溶液,精制时通常在溶液中依次加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,过滤后向滤液中加入盐酸至溶液呈中性。请写出下列操作中发生的化学反应的离子方程式:
等杂质,精制后可得NaCl饱和溶液,精制时通常在溶液中依次加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,过滤后向滤液中加入盐酸至溶液呈中性。请写出下列操作中发生的化学反应的离子方程式:
①粗盐溶液中加入过量的Na2CO3溶液:____________________;_____________________。
②滤液中加入盐酸至溶液呈中性:________________________;_______________________。
(2) 母液中含有K+、Na+、Mg2+等阳离子,从以上流程可以看出,对母液进行一系列的加工可制得金属镁。
①从离子反应的角度思考,在母液中加入石灰乳所起的作用是_____________________;若加入石灰乳后所制取的产品中还混杂着熟石灰,那么将熟石灰从该产品中除去的方法是________________________。
②电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用作镁蒸气的冷却剂的是________(填字母序号)。
A.H2 B.CO2 C.O2 D.水蒸气
(3)在该化工厂中,海水提取氯化钠后的母液经过提取氯化镁后又形成了新的母液,向新的母液中加入一种常见的气态氧化剂,又抽取了重要的化工原料溴单质。
①生成溴单质的化学反应的离子方程式是___________________________________;生产中利用溴单质的挥发性将溴单质从化合物中分离出来的方法是________________________。
②以下是对生产溴单质所用的气态氧化剂寻找供货源的设想,其中合理的是_________(填字母序号)。
A.从外地购买
B.在当地新建生产厂
C.从本厂生产烧碱处循环
D.从本厂生产镁单质处循环
③从多种经营、综合开发、打造大而强的现代企业以及本厂生产所需要的原料等方面来看,你认为该化工厂还可以再增加的生产项目是_________________________________。
【答案】 Ca2++CO![]() ===CaCO3↓ Ba2++CO
===CaCO3↓ Ba2++CO![]() ===BaCO3↓ CO
===BaCO3↓ CO![]() +2H+===H2O+CO2↑ OH-+H+===H2O 使Mg2+变为Mg(OH)2沉淀 加入MgCl2溶液后搅拌,过滤 A 2Br-+Cl2===2Cl-+Br2 空气吹出法 CD 生产盐酸
+2H+===H2O+CO2↑ OH-+H+===H2O 使Mg2+变为Mg(OH)2沉淀 加入MgCl2溶液后搅拌,过滤 A 2Br-+Cl2===2Cl-+Br2 空气吹出法 CD 生产盐酸
【解析】(1)Ca2+用碳酸钠除去,Mg2+用氢氧化钠除去,SO42-用氯化钡除去,最后加入盐酸酸化。但由于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,而氢氧化钠可以随意调整。则①粗盐溶液中加入过量的Na2CO3溶液是反应的离子方程式为Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓。②滤液中加入盐酸至溶液呈中性时反应的离子方程式为CO32-+2H+=H2O+CO2↑、OH-+H+=H2O。(2)①贝壳的主要成分为碳酸钙,碳酸钙加热分解得到氧化钙,氧化钙与水反应生成石灰乳,加入石灰乳沉淀镁离子,过量的氢氧化钙可以加入氯化镁溶液沉淀后过滤除去;②能和金属镁发生反应的气体:水蒸气反应生成氢氧化镁和氢气、氧气生成氧化镁、二氧化碳生成碳和氧化镁,所以可以用氢气、惰性气体等做镁蒸气的冷却剂,答案选A。(3)①因氯气能氧化溴离子得到氯离子和单质溴:2Br-+Cl2=2Cl-+Br2,萃取能富集溴,工业生产中将溴单质从混合物中分离出来应采用萃取的方法,热空气吹出法得到溴单质,将溴单质从混合物中分离出来是基于溴单质的挥发性;②提取Br2,用的气态氧化剂为氯气,本厂生产烧碱为电解氯化钠溶液,产物中有氯气,本厂生产镁单质,是电解无水氯化镁,电解氯化镁的产物为镁和氯气,溴单质具有挥发性,将溴单质从混合物中分离出来是基于溴单质的挥发性,答案选CD;③反应中还有氢气和氯气生成,因此该化工厂还可以再增加的生产项目是生成盐酸。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】在强酸性溶液中能大量共存且溶液为无色透明的一组离子的是
A.Cu2+、Na+、CO32-、SO42-
B.K+、Cl-、Na+、SO42-
C.Na+、NO3-、HCO3-、K+
D.Fe2+、MnO4-、Cl-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于氧化还原反应的是( )
A.Al(OH)3+3HCl==AlCl3+3H2O B.3Fe+4H2O(g)==Fe3O4+4H2
C.3NO2+H2O==2HNO3+NO D.Cl2+H2O==HCl+HclO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现:一节电池烂在地里,能够使一平方米的土地失去利用价值。废旧电池的危害上要集中在其中所含的少量重金属上。将废旧锌锰电池回收处理,既能减少它对环境的污染,又能实现废电池的资源化利用。
(1)回收填料中的二氧化锰和氯化铵。已知:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水。回收物质的流程如图所示。
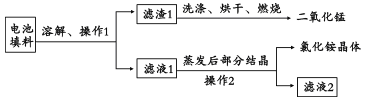
① 操作中先将电池填料研碎的目的是:________________。
② 操作l和操作2的名称都是___________,该操作中玻璃棒的作用是___________。
③ 灼烧滤渣l的目的是______________________。
(2)回收二氯化锰:将废旧锌锰电池处理,得到含锰混合物,向该混合物加入浓盐酸并加热。
①写出MnOOH与浓盐酸反应的化学方程式:________________。
② 锰回收新方法:向废旧锌锰电池内的混合物[主要成分MnOOH、Zn(OH)2]中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,写出MnOOH参与反应的化学方程式______________。与使用浓盐酸回收锰相比,新方法的优点是___________(答l点即可)。
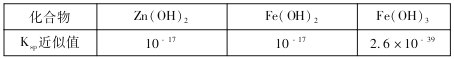
(3)用废电池的锌皮可用于回收制作ZnSO4·7H2O。过程中,需除去锌皮中的少量杂质铁,其方法是:常温下,加入稀H2SO4和H2O2,铁溶解变为Fe3+,加碱调节pH为4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中c(Fe3+)=_________。继续加碱调节pH为____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。部分难溶的电解质溶度积常数(Ksp)如下表:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,一定条件下将lmolA气体和3molB气体充入一个体积可变的密闭容器中,可滑动活塞的位置图1所示。在恒温恒压下发生A(g)+3B(g) ![]() 2C(g),当反应达到平衡时,活塞位置如图2所示,则平衡时A的转化率为( )
2C(g),当反应达到平衡时,活塞位置如图2所示,则平衡时A的转化率为( )
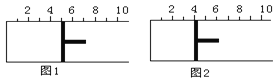
A. 20% B. 40% C. 50% D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在容积固定的某密闭容器中发生反应N2+3H2![]() 2NH3。在10s内N2的浓度由5 mol·L-1降至4 mol·L-1,下列说法正确的是( )
2NH3。在10s内N2的浓度由5 mol·L-1降至4 mol·L-1,下列说法正确的是( )
A. 用NH3表示的化学反应速率为0.1 mol·L-1·s-1
B. 使用合适的催化剂,可以加快该反应的速率
C. 增加H2的浓度或降低温度都会加快该反应速率
D. 反应足够长时间,N2、H2中至少有一种物质浓度降为零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的单质及化合物(或溶液)的转化关系:
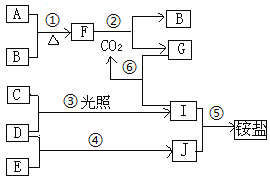
已知B、C、D、E是非金属单质,且在常温下都是气体;化合物G的焰色反应为黄色,化合物I、J通常状况下呈气态;反应④是化工生产中的一种重要固氮反应。请回答下列问题:
(1)写出A、B元素在周期表中的位置:A__________________ B__________________
(2)①~⑥反应中属于氧化还原反应的是 ___________________________________(填序号)
(3)写出②的化学方程式: _____________________________
⑥的离子方程式:______________________________________
(4)反应⑤的现象是________,J的另一种检验方法及现象是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
A. 在溴水中存在如下平衡:Br2+H2O![]() HBr+HBrO,当加入NaOH溶液后颜色变浅
HBr+HBrO,当加入NaOH溶液后颜色变浅
B. 对2H2O2![]() 2H2O+O2的反应,使用MnO2可加快制O2的反应速率
2H2O+O2的反应,使用MnO2可加快制O2的反应速率
C. 反应CO+NO2![]() CO2+NO ΔH<0,升高温度使平衡向逆反应方向移动
CO2+NO ΔH<0,升高温度使平衡向逆反应方向移动
D. 合成氨反应:N2+3H2![]() 2NH3 ΔH<0,为使氨的产率提高,应采取低温高压的措施
2NH3 ΔH<0,为使氨的产率提高,应采取低温高压的措施
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com