

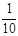 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00ml。请回答下列问题:
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00ml。请回答下列问题: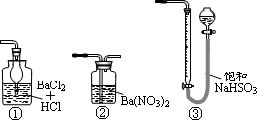


科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
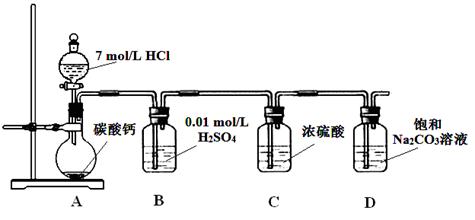

查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
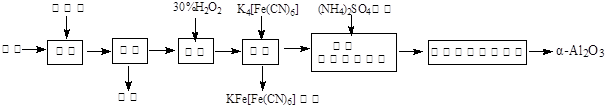
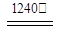 2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过图9所示的装置。
2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过图9所示的装置。

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.用装置(Ⅰ)加热草酸晶体获取某些气体(草酸晶体的熔点101.5 ℃,分解温度约为150 ℃) |
| B.用装置(Ⅱ)进行实验时,酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 |
| C.用装置(Ⅲ)进行实验时,广口瓶内先有浅红棕色气体出现后又变为无色,且不会产生空气污染 |
| D.用装置(Ⅳ)分离溴苯和苯的混合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
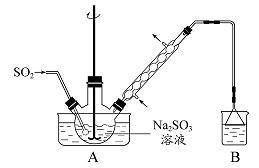
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
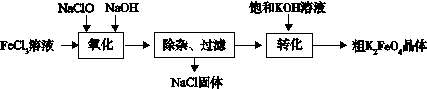
 3Zn(OH)2 + 2Fe(OH)3 + 4KOH
3Zn(OH)2 + 2Fe(OH)3 + 4KOH 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
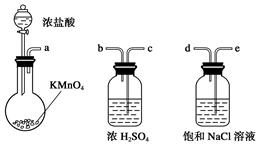
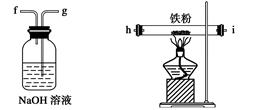
| A.a-b-c-d-e-e-f-g-h |
| B.a-e-d-c-b-h-i-g |
| C.a-d-e-c-b-h-i-g |
| D.a-c-b-d-e-h-i-f |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
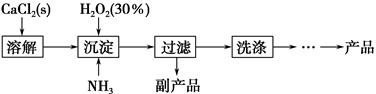
| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.300 0 | 1.02 | 24.04 |
| 2 | 0.300 0 | 2.00 | 25.03 |
| 3 | 0.300 0 | 0.20 | 23.24 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com