
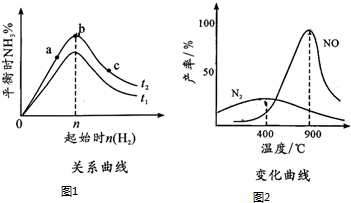
���� ��1��������ʱ�¶���ͬ��������Խ������ת����Խ��
�ڸ�������ʽ���K=$\frac{��������ƽ��Ũ��ϵ������֮��}{������Ӧ��ƽ��Ũ��ϵ������֮��}$���м��㣻
����ͼ��֪������������ͬʱ��T1�ȴﵽƽ����ƽ��ʱ������Ũ��С��
��2������ͼ���֪�¶ȵ�ʱ���ɵ������¶ȸ�ʱ����NO�����÷�ӦΪ���ȷ�Ӧ�����¶ȸ���900��ʱ��NO�����½���������������ԭ����д�Ȼ�ѧ����ʽ��
��� �⣺��1��������ʱ�¶���ͬ��������Խ������ת����Խ����c���ת������ߣ��ʴ�Ϊ��C��
��N2��g��+3H2��g��?2NH3��g��
��ʼ x 3 0
ת��0.6 1.8 1.2
ƽ��x-0.6 1.2 1.2
N2��ת����Ϊ60%����$\frac{0.6}{x}$��100%=60%�����x=1mol��������ʼʱ��ϵ�м���N2�����ʵ���Ϊ1mol����Ӧ��ƽ�ⳣ��K=$\frac{1��{2}^{2}}{0.4��1��{2}^{3}}$=2.08��mol/L��-2��
�ʴ�Ϊ��1��2.08��mol/L��-2��
����ͼ��֪������������ͬʱ��T1�ȴﵽƽ����ƽ��ʱ������Ũ��С����T2����T1���ʴ�Ϊ�����ڣ�
��2������ͼ���֪�¶ȵ�ʱ���ɵ������¶ȸ�ʱ����NO�����÷�ӦΪ���ȷ�Ӧ�����¶ȸ���900��ʱ��NO�����½���
��֪��4NH3��g��+5O2��g��?4NO��g��+6H2O��l����H=-a kJ•mol-1
��4NH3��g��+3O2��g��?2N2��g��+6H2O ��l����H=-b kJ•mol-1
����-�ڣ���2�ã�N2��g��+O2��g��=2NO��g����H=+��b-a��/2 kJ•mol-1
�ʴ�Ϊ��N2��������������NO�ķ�Ӧ�Ƿ��ȷ�Ӧ�������¶�ת�����½���N2��g��+O2��g��=2NO��g����H=+��b-a��/2 kJ•mol-1��
���� ���⿼��������ͼ��ķ����Լ�����������ԭ����ƽ����йؼ���ȣ���Ŀ�Ѷ��еȣ�


 ȫ�ܲ��һ���þ�ϵ�д�
ȫ�ܲ��һ���þ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | �÷�Ӧ���ڷֽⷴӦ | B�� | ͼ�е����ֻ����ﶼ���������� | ||
| C�� | �÷�Ӧ��Ԫ�صĻ��ϼ�û�б仯 | D�� | ��Ӧǰ��ԭ�ӵ�����ı� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��ij�ݻ�һ�����ܱ������У����淴Ӧ��A��g��+B��g���TxC��g����ͼ����ʾ�ķ�Ӧ���ߣ����ж϶�ͼ���˵������ȷ���ǣ�T��ʾ�¶ȣ�p��ʾѹǿ��C%��ʾC�������������������
��ij�ݻ�һ�����ܱ������У����淴Ӧ��A��g��+B��g���TxC��g����ͼ����ʾ�ķ�Ӧ���ߣ����ж϶�ͼ���˵������ȷ���ǣ�T��ʾ�¶ȣ�p��ʾѹǿ��C%��ʾC�������������������| A�� | p3��p4��y���ʾA�����ʵ��� | |
| B�� | p3��p4��y���ʾB��������� | |
| C�� | p3��p4��y���ʾ���������ܶ� | |
| D�� | p3��p4��y���ʾ��������ƽ����Է������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 �����仯�����ڹ�ҵ���������������й㷺Ӧ�ã��ش��������⣺
�����仯�����ڹ�ҵ���������������й㷺Ӧ�ã��ش��������⣺ ��
��| ��ѧ�� | N-H | N-N | N�TN | N��N | O�TO | O-H |
| ���ܣ�kJ/mol�� | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
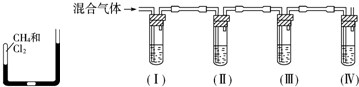
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �п��淴Ӧ��Fe��s��+CO2��g��?FeO��s��+CO��g������֪938Kʱƽ�ⳣ��K=1.47��1173Kʱƽ�ⳣ��K=2.15��
�п��淴Ӧ��Fe��s��+CO2��g��?FeO��s��+CO��g������֪938Kʱƽ�ⳣ��K=1.47��1173Kʱƽ�ⳣ��K=2.15���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ��֪KMnO4��MnO2�����������¾��ܽ����� ��H2C2O4��������
��֪KMnO4��MnO2�����������¾��ܽ����� ��H2C2O4���������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 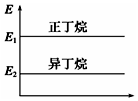 ���������춡���������С��ϵ��ͼ | |
| B�� | ��������ȶ��Դ����춡�� | |
| C�� | �춡��ת��Ϊ������Ĺ�����һ�����ȹ��� | |
| D�� | �춡������е�̼�����������Ķ� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com