
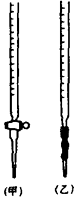
 已知KMnO4、MnO2在酸性条件下均能将草酸 (H2C2O4)氧化:
已知KMnO4、MnO2在酸性条件下均能将草酸 (H2C2O4)氧化:分析 ①反应中MnO4-→Mn2+,锰元素化合价由+7价降低为+2价,共降低5价,H2C2O4→CO2,碳元素化合价由+3价升高为+4,共升高2价,化合价最小公倍数为10,故MnO4-系数为2,H2C2O4系数为5,再根据元素守恒、电荷守恒确定其它物质的系数;
②KMnO4溶液呈紫色,草酸反应完毕,滴入最后一滴KMnO4溶液,紫色不褪去,滴定到终点,因高锰酸钾具有强氧化性,应装在酸式滴定管中;
③题中没有告诉使用的容量瓶的规格,无法知道配制的溶液的体积;
④A.滴定前有气泡,导致消耗的标准液体积增大;
B.没有洗涤烧杯、玻璃棒,导致配制的样品溶液的溶质物质的量减小;
C.滴定前仰视读数,读数会偏大,滴定后俯视读数,读数会偏小,最终计算结果偏小;
D.定容时俯视刻度线,会导致配制的样品溶液的体积偏小,溶液的浓度偏大;
E.锥形瓶不需要润洗,操作正确.
解答 解:①反应中MnO4-→Mn2+,锰元素化合价由+7价降低为+2价,共降低5价,H2C2O4→CO2,碳元素化合价由+3价升高为+4,共升高2价,化合价最小公倍数为10,故MnO4-系数为2,H2C2O4系数为5,再根据元素守恒可知Mn2+系数为2、CO2系数为10,根据电荷守恒可知H+系数为16,根据氢元素守恒可知H2O系数为8,配平后离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2+8H2O;
故答案为:5;
②高锰酸钾具有强氧化性,应装在酸式滴定管中,甲是酸式滴定管,乙是碱式滴定管;
草酸与酸性高锰酸钾发生氧化还原反应,当滴定到终点时,二者恰好完全反应,再滴入一滴KMnO4溶液变成紫色(或红色)且半分钟不褪色,可说明达到滴定终点,
故答案为:甲;当看到滴入一滴KMnO4溶液,锥形瓶中溶液立即变成紫色,且半分钟不褪色,即达到滴定终点;
③由于操作过程中没有告诉容量瓶的规格是多少,无法知道配制的溶液的体积,
故答案为:否;因为不知道容量瓶的规格;
④根据反应原理,消耗的高锰酸钾标准液体积偏大,高锰酸钾消耗的草酸根离子偏大,二氧化锰消耗的草酸根离子会偏小,测定的二氧化锰的含量偏小,
A.滴定前尖嘴部分有一气泡,滴定终点时消失,滴定前有气泡,滴定时消耗的高锰酸钾标准液体积偏大,测定的二氧化锰含量偏低,故A正确;
B.溶液转移至容量瓶中,未将烧杯、玻棒洗涤,没有洗涤烧杯、玻璃棒,会导致配制的样品溶液的溶质物质的量减小,滴定是消耗的高锰酸钾溶液偏小,测定的二氧化锰的含量结果偏高,故B错误;
C.滴定前仰视读数,滴定后俯视读数:滴定前仰视读数,读数会偏大,滴定后俯视读数,读数会偏小,最终计算结果偏小,消耗的高锰酸钾溶液偏小,测定的二氧化锰含量偏高,故C错误;
D.定容时,俯视刻度线,会导致配制的样品溶液的体积偏小,溶液的浓度偏大,用高锰酸钾溶液滴定时,消耗的高锰酸钾溶液的体积偏大,测定的二氧化锰含量偏低,故D正确;
E.锥形瓶水洗之后未用待测液润洗,锥形瓶不需要润洗,此操作正确,对滴定结果没有影响,故E错误;
故答案为:AD.
点评 本题考查氧化还原反应配平、氧化还原反应滴定运用、误差分析等,题目难度中等,明确氧化还原反应原理、以及滴定原理和误差分析方法是解题的关键,侧重于考查学生的分析能力和对基础知识的综合应用能力.


科目:高中化学 来源: 题型:填空题
| 难溶电解质 | CaCO3 | CaSO4 |
| Ksp | 2.8×10-9 | 9×10-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20 mol、25% | B. | 20 mol、75% | C. | 40 mol、30% | D. | 10mol、50% |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入过量Na2CO3溶液:Na+、Ca2+、NH4+、NO3-、H+ | |
| B. | 加入适量NaHCO3溶液:Na+、Ca2+、NH4+、NO3-、HCO3- | |
| C. | 加入适量NaOH溶液:Na+、Ca2+、NH4+、NO3-、OH- | |
| D. | 加入过量FeSO4和稀硫酸:Fe2+、Fe3+、NH4+、Ca2+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6L CCl4含有的分子数为0.25NA | |
| B. | 标准状况下,14 g氮气含有的核外电子数为5NA | |
| C. | 标准状况下,22.4 L任意比的氢气和氯气的混气中含有分子总数均为NA | |
| D. | 在标准状况下,18gH2O所含有的电子数不是10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蘸浓盐酸的玻璃棒靠近盛放氨气的装置,检查是否漏气 | |
| B. | 浓硫酸沾在皮肤上,立刻用稀氢氧化钠溶液冲洗 | |
| C. | 液溴应保存在棕色磨口玻璃塞的试剂瓶中,并加少量水进行水封 | |
| D. | 为防止被氧化,FeSO4溶液存放在加有少量铁粉的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与碱反应生成盐和水 | B. | 使紫色石蕊试液变蓝色 | ||
| C. | 与活泼金属反应生成盐和氢气 | D. | 与氧化钠反应生成盐和水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com