
| A. | 用蘸浓盐酸的玻璃棒靠近盛放氨气的装置,检查是否漏气 | |
| B. | 浓硫酸沾在皮肤上,立刻用稀氢氧化钠溶液冲洗 | |
| C. | 液溴应保存在棕色磨口玻璃塞的试剂瓶中,并加少量水进行水封 | |
| D. | 为防止被氧化,FeSO4溶液存放在加有少量铁粉的试剂瓶中 |
分析 A.氯化氢和氨气反应生成白烟;
B.氢氧化钠具有腐蚀性;
C.溴可腐蚀橡胶;
D.铁与铁离子反应可生成亚铁离子.
解答 解:A.浓盐酸易挥发,与NH3结合生成NH4Cl固体小颗粒,为白烟,故A正确;
B.浓硫酸和氢氧化钠都具有强腐蚀性,所以在实验中如果不慎将浓硫酸沾到皮肤上,应立即先用抹布拭去,然后用大量水冲洗,然后涂上3%~5%的碳酸氢钠溶液,故B错误;
C.溴可腐蚀橡胶,应用玻璃塞,且溴的密度比水大,可用水封,故C正确;
D.铁与铁离子反应可生成亚铁离子,加热铁粉可防止亚铁被氧化,故D正确.
故选B.
点评 本题考查较为综合,涉及化学安全事故及处理方法等知识,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意相关知识的学习与积累,难度不大.


科目:高中化学 来源: 题型:选择题
 在某容积一定的密闭容器中,可逆反应:A(g)+B(g)═xC(g)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,p表示压强,C%表示C的体积分数)( )
在某容积一定的密闭容器中,可逆反应:A(g)+B(g)═xC(g)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,p表示压强,C%表示C的体积分数)( )| A. | p3>p4,y轴表示A的物质的量 | |
| B. | p3<p4,y轴表示B的体积分数 | |
| C. | p3<p4,y轴表示混合气体的密度 | |
| D. | p3>p4,y轴表示混合气体的平均相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 已知KMnO4、MnO2在酸性条件下均能将草酸 (H2C2O4)氧化:
已知KMnO4、MnO2在酸性条件下均能将草酸 (H2C2O4)氧化:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
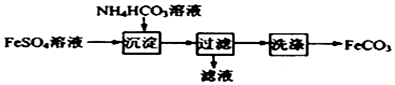
| A. | 产品FeCO3在空气中高温分解可得到纯净的FeO | |
| B. | 可利用KSCN溶液检验FeSO4溶液是否变质 | |
| C. | 沉淀过程中有CO2气体放出 | |
| D. | 检验沉淀是否洗涤干净可用盐酸酸化的BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
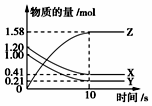 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )| A. | 反应开始到10 s,用Z表示的反应速率为0.079mol•(L•s)-1 | |
| B. | 反应开始到10 s,X的物质的量浓度减少了0.79mol•L-1 | |
| C. | 该反应不是可逆反应 | |
| D. | 反应的化学方程式为X(g)+Y(g)?Z(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 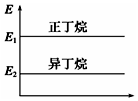 正丁烷与异丁烷的能量大小关系如图 | |
| B. | 正丁烷的稳定性大于异丁烷 | |
| C. | 异丁烷转化为正丁烷的过程是一个放热过程 | |
| D. | 异丁烷分子中的碳氢键比正丁烷的多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com