
【题目】Ⅰ.有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
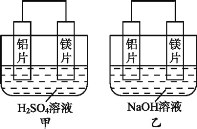
(1)写出甲中正极的电极反应式:____。
(2)乙中负极为__,总反应的离子方程式:___。
(3)由此实验得出的下列结论中,正确的有____。
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,没有实用价值了
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析
Ⅱ.化学电池在通信、交通及日常生活中有着广泛的应用。目前常用的镍镉(NiCd)电池,其电池总反应可以表示为:Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是____(填字母序号)。
2Ni(OH)2+Cd(OH)2已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是____(填字母序号)。
①放电时Cd作正极 ②放电时Ni元素被还原
③充电时化学能转变为电能 ④放电时化学能转变为电能
Ⅲ.氢气和氧气可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式(当电解质溶液为NaOH(aq)或KOH(aq)时)两种。试回答下列问题:
(1)酸式电池的电极反应:正极_____;
(2)碱式电池的电极反应:负极_______。
【答案】2H++2e-H2↑ Al 2Al+2OH-+2H2O2AlO2-+3H2↑ AD ②④ O2+4e-+4H+2H2O 2H2-4e-+4OH-4H2O
【解析】
Ⅰ.甲中镁易失电子作负极、Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应;乙池中铝易失电子作负极,负极上铝失电子发生氧化反应,镁作正极,正极发生还原反应,通过对比甲乙实验可知,电解质溶液的酸碱性可能影响电极反应式,电池的正负极判断除了与金属活动性顺序有关,还与电解质有关,据此分析作答;
Ⅱ.根据总反应式结合原电池与电解池的工作原理作答;
Ⅲ. 正极上,O2得电子变为O2-,溶液中O2-不能单独存在,酸性条件下与H+结合生成H2O,碱性条件下与H2O分子结合生成OH-;负极上,酸性条件下H2失电子变为H+,H+进入电解质溶液;碱性条件下H+不能大量存在,与OH-结合生成水。两种环境下电池总反应均是H2和O2生成水的反应。
Ⅰ.根据原电池原理可知,甲中总反应是镁与稀硫酸反应生成硫酸镁与氢气,镁作负极发生失电子的氧化反应,正极上氢离子得电子发生还原反应,其电极反应式为:2H++2e-=H2↑;
(2)乙中铝与氢氧化钠和水发生氧化还原反应,因此铝作该电池的负极,总的离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:Al;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)
A. 利用原电池反应判断金属活动性顺序时应注意选择合适的介质,如酸性条件下活泼金属做负极,而碱性条件下就不一定,A项正确;
B. 镁的金属性比铝的金属性强,B项错误;
C.该实验说明金属活动性顺序表主要指的是酸性条件下金属的还原性,C项错误;
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析,D项正确;
答案选AD;
Ⅱ.电池总反应可以表示为:Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2,则,
2Ni(OH)2+Cd(OH)2,则,
①放电时,Cd转化为Cd(OH)2,元素化合价升高,发生失电子的氧化反应,作原电池的负极,①项错误;
②放电时,Ni元素从+3价降低到+2价,元素被还原,②项正确;
③充电过程利用的是电解池的工作原理,是将电能转化为化学能,③项错误;
④放电过程利用的是原电池的工作原理,是将化学能转变为电能,④项正确;
综上所述,②④项正确,答案为:②④;
Ⅲ. 根据上述分析可知,
(1)酸式电池正极上O2得电子转化为H2O,其电极反应式为:O2+4e-+4H+=2H2O;
(2)碱式电池负极氢气失电子转化为水,其电极反应式为:2H2-4e-+4OH-=4H2O。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】巨豆三烯酮(F)是一种重要的香料,其合成路线如下:
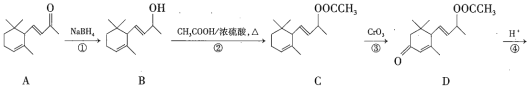
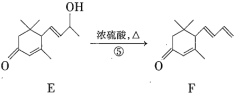
(1)化合物F的分子式为_____________,1mol该物质完全燃烧需消耗________molO2。
(2)在上述转化过程中,反应②的目的是______________,写出反应②的化学方程式:_______________。
(3)下列说法正确的是___________(填序号)。
A.化合物A~F均属于芳香烃的衍生物 B.反应①属于还原反应
C.1mol化合物D可以跟4molH2发生反应 D.化合物F中所含官能团的名称为碳碳双键、羰基
(4)符合下列条件的D的同分异构体有两种,其中一种同分异构体的结构简式如下图所示,请写出另一种同分异构体的结构简式:__________________。
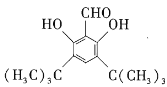
a.属于芳香化合物 b.核磁共振氢谱显示,分子中有4种不同类型的氢原子
c. 1mol该物质最多可消耗2mol NaOH d.能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞(J)是用于脑血管疾病治疗的药物。它的某种合成路线如下:
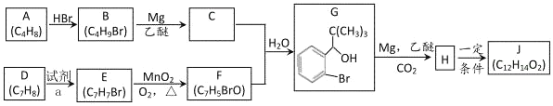
已知: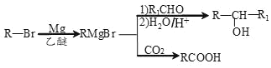
请回答下列问题:
(1)E 的名称为________,F 中所含官能团名称为_______,H→J 的反应类型为_______。
(2)B 生成 A 的方程式_______。
(3)X 是 H 的同系物,相对分子质量比 H 小 56。满足下列条件 X 的同分异构体共有_______种。
①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应。 其中核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式为_______。
(4)利用题中信息所学知识,写出以甲烷和苯甲醛为原料,合成苯乙烯的路线流程图(其他无机试 剂自选)_______。合成路线流程图表达方法例如下:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向淀粉-碘化钾的酸性溶液中加入少量 H2O2 溶液,溶液立即变蓝,再向蓝色溶液中缓慢通入足量的 SO2, 蓝色逐渐消失。下列判断不正确的是
A.根据上述实验判断 H2O2 和 SO2 反应能生成强酸
B.蓝色逐渐消失,体现了 SO2 的漂白性
C.SO2 中 S 原子采取 sp2杂化方式,分子的空间构型为 V 型
D.H2O2是一种含有极性键和非极性键的极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中常用MnS作为沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq),下列说法正确的是
CuS(s)+Mn2+(aq),下列说法正确的是
A.该反应达到平衡时,c(Mn2+)=c(Cu2+)
B.该反应达到平衡时,Ksp(CuS)较大
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)减小
D.该反应的平衡常数K=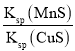
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体离子导体依靠离子迁移传导电流。如图是一种固体电池,Ag+可以在RbAg4I5晶体中迁移,空气中的O2透过聚四氟乙烯膜与AlI3反应生成I2,Ag和I2作用形成原电池。下列说法错误的是( )
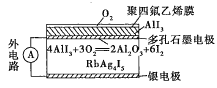
A.I2与Ag反应属于放热反应
B.Ag+从多孔石墨电极向银电极移动
C.多孔石墨电极为正极,银电极为负极
D.银电极的电极反应式为Ag-e-=Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞(J)是用于脑血管疾病治疗的药物。它的某种合成路线如下:

已知:
请回答下列问题:
(1)E 的名称为________,F 中所含官能团名称为_______,H→J 的反应类型为_______。
(2)B 生成 A 的方程式_______。
(3)X 是 H 的同系物,相对分子质量比 H 小 56。满足下列条件 X 的同分异构体共有_______种。
①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应。 其中核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式为_______。
(4)利用题中信息所学知识,写出以甲烷和苯甲醛为原料,合成苯乙烯的路线流程图(其他无机试 剂自选)_______。合成路线流程图表达方法例如下:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】交警用三氧化铬(CrO3)硅胶可以查酒驾。元素Cr的几种化合物转化关系如图所示,下列判断正确的是
CrO3固体![]() K2CrO4溶液
K2CrO4溶液![]() K2Cr2O7溶液
K2Cr2O7溶液![]() CrO2Cl2+COCl2
CrO2Cl2+COCl2
A.反应①表明CrO3有酸性氧化物的性质
B.CrO42-在碱性溶液中不能大量存在
C.只有反应③为氧化还原反应
D.基态铬原子的价电子排布式为3d44s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如下图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸,D中放有饱和碳酸钠溶液。
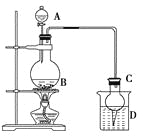
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH;
②有关有机物的沸点如下:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:_____________________________________________________________________。
(2)球形干燥管C的作用是______________。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)__________________________________________;
反应结束后D中的现象是_______________________________________________。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出________;再加入________(此空从下列选项中选择),然后进行蒸馏,收集77 ℃左右的馏分,以得到较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰
C.无水硫酸钠 D.生石灰
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com