
【题目】(1)19.2g SO2在标准状况下的体积为______,其中含氧原子的物质的量为______,该气体在标准状况下的密度是______(若不能整除,保留两位小数)。
(2)0.5mol H3PO4质量是_______,含______个H3PO4分子,含______mol氧原子。
(3)在标准状况下,将体积为______ NH3溶于水得到0.5 mol·L-1的氨水500 mL;配制100 mL 0.1 mol·L-1CuSO4溶液,需要CuSO4·5H2O质量为________。
(4)现有M、N两种气态化合物,其摩尔质量之比为2:1,试回答下列问题:
①同温同压下,M、N气体的密度之比为____________;
②相同温度下,在两个相同体积的密闭容器中分别充入M、N,若两个容器中气体的密度相等,则两个容器中的压强之比为____________。
【答案】 6.72L 0.6mol 2.86g/L 49g 0.5NA 2 5.6L 2.5 g 2:1 1:2
【解析】(1)二氧化硫的物质的量为![]() =0.3mol,标况下体积为0.3mol×22.4L/mol=6.72L,含有氧原子物质的量为0.3mol×2=0.6mol,标况下的密度为
=0.3mol,标况下体积为0.3mol×22.4L/mol=6.72L,含有氧原子物质的量为0.3mol×2=0.6mol,标况下的密度为![]() =2.86g/L;(2)0.5mol H3PO4的质量是0.5mol×98g/mol=49g,根据N=nNA可知磷酸的分子数是0.5mol×6.02×1023mol-1=3.01×1023,n(O)=n(H3PO4)×4=0.5mol×4=2mol;(3)n(NH3)=0.5molL-1×0.5L=0.25mol,V(NH3)=0.25mol×22.4L/mol=5.6L,n(CuSO45H2O)=n(CuSO4)=0.1L×0.1mol/L=0.01mol,m(CuSO45H2O)=0.01mol×250g/mol=2.5g;(4)①相同条件下,M、N气体的密度之比与其摩尔质量成正比,所以二者的密度之比为:2:1;②两个容器中气体的密度相同,则气体的质量相等,物质的量与摩尔质量成反比,而压强与气体的物质的量成正比,则容器中气体的压强与摩尔质量成反比,两个容器中压强之比为:1:2。
=2.86g/L;(2)0.5mol H3PO4的质量是0.5mol×98g/mol=49g,根据N=nNA可知磷酸的分子数是0.5mol×6.02×1023mol-1=3.01×1023,n(O)=n(H3PO4)×4=0.5mol×4=2mol;(3)n(NH3)=0.5molL-1×0.5L=0.25mol,V(NH3)=0.25mol×22.4L/mol=5.6L,n(CuSO45H2O)=n(CuSO4)=0.1L×0.1mol/L=0.01mol,m(CuSO45H2O)=0.01mol×250g/mol=2.5g;(4)①相同条件下,M、N气体的密度之比与其摩尔质量成正比,所以二者的密度之比为:2:1;②两个容器中气体的密度相同,则气体的质量相等,物质的量与摩尔质量成反比,而压强与气体的物质的量成正比,则容器中气体的压强与摩尔质量成反比,两个容器中压强之比为:1:2。


 应用题作业本系列答案
应用题作业本系列答案 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】下列关于[Cr(H2O)4Br2]Br·2H2O的说法正确的是
A.配体为水分子,外界为 Br-
B.中心离子的配位数为6
C.中心原子采取sp3杂化
D.中心离子的化合价为+2价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)Fe2O3是主氧化剂,与Na发生置换反应生成的还原产物为________(填化学式)。
(2)KClO4是助氧化剂,其中含有化学键的类型为________________________。
(3)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为
________________________________________________________________。
(4)NaN3是气体发生剂,受热分解产生N2和Na。取56 g上述产气药剂,分解产生的气体通过碱石灰后的体积为16.8 L(标准状况),该产气药剂中NaN3的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH溶液,生成的沉淀质量与滴入NaOH溶液体积关系如图,则原混合溶液中MgCl2与FeCl3的物质的量之比为
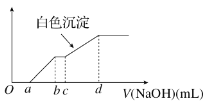
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确有( )个
①常温常压下,28gC2H4和C4H8的混合物中一定含有6NA个原子
②0℃,101Kpa,22.4LCl2通入足量的NaOH溶液充分反应,有2NA个电子转移
③常温下,pH=12的氢氧化钠溶液中OH-数目为0.01NA
④1L1.0mol/LFeCl3溶液全部水解制备氢氧化铁胶体,所得氢氧化铁胶粒数目为NA
⑤T℃时,1 L pH=6纯水中,含10-6NA个H+
⑥常温下,1.7gNH3和3.65gHCl混合后,气体分子数为0.2NA
⑦lmolSO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子
⑧用惰性电极电解CuSO4溶液后,如果加入0.1molCu(OH)2能使溶液复原,则电路中转移电子的数目为0.4NA
⑨标准状况下,22.4LHF气体中含有NA个气体分子
A. 0 B. 1 C. 2 D. 3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种白色晶体A极易溶于水,将A配成溶液进行如下框图所示的实验,实验现象及转化关系如下列框图所示。A为含硫氮正盐其中硫元素化合价为+4,气体D能使品红溶液褪色,气体F能使湿润的红色石蕊试纸变蓝。试回答下列问题:

(1)写出下列物质化学式:D:__________;F:__________。
(2)写出下列反应的离子方程式:
①A和酸性KMnO4溶液反应__________;
②D和新制氯水:__________。
(3)通过本题的解答,在检验SO42-时,应使用__________。
A.盐酸酸化的BaCl2溶液 B.硝酸酸化的Ba(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑
(1)上述反应中被氧化的元素是_______;还原产物是_____________
(2)氧化剂与还原剂的物质的量之比是________________________
(3)上述反应中KMnO4、HCl(浓)、MnCl2、 Cl2四中微粒氧化性由强到弱的顺序为:_________________________________________
(4)标明该反应电子转移方向和数目:_______________________________________
Ⅱ.(1)V L Fe2(SO4)3溶液中含Fe3+ a g,则该溶液中Fe3+的物质的量浓度为____molL﹣1,溶质的物质的量浓度为______ molL﹣1.
(2)12.4g Na2X含有0.4mol Na+,该物质的化学式__________.
(3)为了供学生课外活动,要求把SO42-、CO32-、H+、OH-、NH4+、Fe3+、Na+七种离子根据共存原理分为两组混合溶液,两组的离子数目要接近。分配结果是:
第一组:____________________;第二组:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲是一种利用微生物将废水中的尿素(H2NCONH2,氮元素显3价)的化学能直接转化为电能,并生成对环境无害物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中正确的是

A.H+透过质子交换膜由右向左移动
B.铜电极应与X相连接
C.M电极的反应式:H2NCONH2+H2O6e![]() CO2↑+N2↑+6H+
CO2↑+N2↑+6H+
D.当N电极消耗0.5 mol气体时,则铁电极增重32 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com