
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
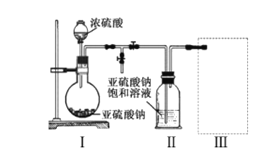
实验一 焦亚硫酸钠的制取
采用右图装置(实验前已除尽装置内的空气)制取Na2S2O5。 装置II中有Na2S2O5晶体析出,发生的反应为: Na2SO3+SO2=Na2S2O5
(1)装置1中产生气体的化学方程式为_____________________
(2)要从装置II 中获得已析出的晶体,可采取的分离方法是_____________________
(3)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为___(填序号)。

实验二 焦亚硫酸钠的性质
已知: Na2S2O5 易被氧化,溶于水即生成NaHSO3
(4)检验Na2S2O5晶体在空气中已被氧化的实验方案是____________________。
(5)设计实验证明NaHSO3溶液中HSO3-的电离程度大于水解程度___________________________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。则定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,滴定终点的现象是______________________________。滴定时消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________kg/L。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果____________(填“偏高”“偏低”或“不变”)。
【答案】 Na2SO3+H2SO4=Na2SO4+SO2↑+H2O(或Na2SO3+2H2SO4=2NaHSO4+SO2↑+H2O) 过滤 d 取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量盐酸,振荡,再滴入氯化钡溶液,有白色沉淀生成 测定NaHSO3溶液pH值,若pH<7,则HSO3-的电离程度大于水解程度 滴入最后一滴溶液,溶液颜色由无色变为蓝色,且30s内不褪色 1.6×10-4 偏低
【解析】本题主要考查对于有关焦亚硫酸钠探究实验的评价。
(1)装置1中发生“强酸制弱酸”的反应,产生二氧化硫气体,反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O(或Na2SO3+2H2SO4=2NaHSO4+SO2↑+H2O)
(2)要从装置II中获得已析出的晶体,可采取的分离方法是过滤。
(3)a.二氧化硫不能与氨水充分作用,稀氨水吸收二氧化硫的能力有限,封闭装置不安全;b.食盐水吸收二氧化硫的能力有限,溶解过程存在可逆反应而使溶解不完全,二氧化硫与食盐水的作用受到限制;c.二氧化硫不溶于浓硫酸;d.二氧化硫可充分被氢氧化钠溶液吸收,该装置还可以防止倒吸。故选d。
(4)Na2S2O5可被空气中氧气氧化为Na2SO4,Na2S2O5遇盐酸会转化为SO2,检验Na2S2O5晶体在空气中已被氧化就是检验晶体中含有Na2SO4,应在除去可能存在的Na2S2O5的前提下,将Na2SO4转化为硫酸钡沉淀。实验方案是取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量盐酸,振荡,再滴入氯化钡溶液,有白色沉淀生成。
(5)证明NaHSO3溶液中HSO3-的电离程度大于水解程度就是证明NaHSO3溶液呈酸性,实验方法:测定NaHSO3溶液pH值,若pH<7,则HSO3-的电离程度大于水解程度。
(6)①按上述方案实验,当上述滴定反应完成时,过量的标准I2溶液遇淀粉变蓝色,所以滴定终点的现象是滴入最后一滴溶液,溶液颜色由无色变为蓝色,且30s内不褪色。滴定时消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为0.01000mol/L×25.00mL×64g/mol/100mL=1.6×10-4kg/L。
②在上述实验过程中,若有部分HI被空气氧化,使得消耗标准I2溶液体积减少,则测定结果偏低。


科目:高中化学 来源: 题型:
【题目】中国女药学家屠呦呦因发现青蒿素对疟疾的治疗作用而成为2015年诺贝尔生理医学奖获得者之一.下列说法不正确的是( ) 
A.从青蒿中提取青蒿素的方法是以萃取原理为基础,萃取是一种化学变化
B.青蒿素的分子式为C15H22O5 , 它属于有机物
C.人工合成青蒿素经过了长期的实验研究,实验是化学研究的重要手段
D.现代化学分析测试中,可用元素分析仪确定青蒿素中的C,H,O元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示转化关系,A为单质,试对下列情况进行推断,并回答下列问题: 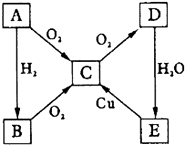
(1)A为固体时:
①A的化学式为 ,
②写出由C生成D的化学方程式 ,
③写出由E生成C的化学方程式;
(2)A为气体时:
①A的化学式为 ,
②写出由B生成C的化学方程式 ,
③写出由D生成E的离子方程式 ,
④写出由E生成C的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律.
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律.图2中,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气和MnCl2等.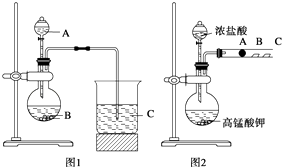
(1)甲同学实验中选用的物质化学式为:A , B , C;
(2)C处反应的离子方程式为;
(3)写出乙同学的实验中圆底烧瓶中发生反应的化学方程式;
(4)A处反应的离子方程式为;
(5)B处的实验现象为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的数值,则下列说法中正确的是( )
A.44gCO2所含质子数为44NA个
B.常温常压,11.2L氧气含原子数为NA个
C.2.3g钠变为离子失电子数0.1NA
D.常温常压下,NA个氢原子的质量为2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.天然橡胶的主要成分是聚异戊二烯
B.石油主要成分只有烷烃和环烷烃
C.现代工业中石油催化重整是获得芳香烃的主要途径
D.溴乙烷是向有机化合物分子中引入乙基的重要试剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水和苯不互相溶,苯不与钠反应,在烧杯中加水和苯,将一小块钠投入烧杯中,观察到的现象可能是
A. 钠在水层中反应并四处游动 B. 钠停留在苯层中不发生反应
C. 钠在苯的液面上反应并四处游动 D. 钠在苯与水的界面处反应,可能做上下跳动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com