
【题目】(1)有①![]() 、
、![]() 、
、![]() ;②H2、D2、T2;③石墨、金刚石;④
;②H2、D2、T2;③石墨、金刚石;④![]() 、
、![]() 、
、![]() ;四组微粒或物质。互为同位素的是________(填编号,下同),互为同素异形体的是_________。
;四组微粒或物质。互为同位素的是________(填编号,下同),互为同素异形体的是_________。
(2)已知拆开1 mol H—H键、1 mol N≡N、1 mol N—H键分别需要吸收的能量为436kJ、946k J、391k J。则由氢气和氮气反应生成1 mol NH3需要__________(填“放出”或“吸收”)___________kJ能量。
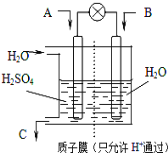
(3)控制和治理SO2是减少酸雨的有效途径,有学者设想以如图所示装置用电化学原理将他们转化为重要化工原料。若A为SO2,B为O2,C为H2SO4。则负极是 ______ (填“A”或“B”),负极反应式为 ______________ 。
(4)已知由甲烷CH4和氧气构成的燃料电池,电解质溶液为KOH溶液时,负极通入的气体为_______,(填化学式),负极反应式为______________
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计的制取溴苯的实验装置如下图所示:

装置A是酸式滴定管,分液漏斗中是苯和液溴的混合物,打开分液漏斗的活塞,使混合物滴在铁丝上(酸式滴定管活塞关闭)。请回答下列问题:
(1)A选用酸式滴定管而不用碱式滴定管的原因是___________________。
(2)A中反应的化学方程式是________________。
(3)垂直于A的导气管要做得长一些,是为了_________________。
(4)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是______________,反应的化学方程式是___________________。
(5)C中盛放四氯化碳的作用是_______________。
(6)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入硝酸银溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入_____________,现象是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是

A. 该硫酸的物质的量浓度为9.2mo1/L
B. 该硫酸与等体积的水混合所得溶液的质量分数为49%
C. 配制250mL 4.6mo1/L的稀硫酸需取该硫酸62.5mL
D. 该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2mo1/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是

A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于置换反应X+M→Y+N(未配平,反应条件略去),其中X、Y为单质,M、N为化合物,下列说法中错误的是( )
A. 若M为H2O,则Y可能为O2
B. 若M为NH3,则X可能为Cl2
C. 若Y为Fe,则X一定是H2
D. 若Y为C,则N可能为MgO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反为:3Zn+2K2FeO4+8H2O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A. 放电时负极反应式为:Zn-2eˉ+2OHˉ=Zn(OH)2
B. 放电时每转移3mol电子,正极有1 mol K2FeO4被还原
C. 放电时正极反应式为:Fe(OH)3-3eˉ+5OHˉ=FeO42-+4H2O
D. 放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】归纳整理是科学学习的重要方法之一。氧族元素的各种性质可归纳整理为如下表所示的表格(部分)。
8O | 16S | 34Se | 52Te | |
单质熔点(℃) | -218.4 | 113 | 450 | |
单质沸点(℃) | -183 | 444.6 | 685 | 989 |
主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
原子半径 | 逐渐增大 | |||
单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
请根据表回答下列问题:
(1)硒的熔点范围可能是___________。
(2)碲的化合价可能有__________。
(3)氢硒酸有较强的________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生反应的化学方程式为_______________。
(4)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:______Al2Te3+______=____Al(OH)3+______H2Te↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,2.24 LCH3OH中含有的原子数目为6 NA
B. 18 g 2H2O中含有的电子数目为10 NA
C. 25℃时,1 L pH=13的Ba(OH)2溶液中含有OH-数为0.05 NA
D. 常温下,21 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取软锰矿石(主要成分为MnO2)116g 跟足量浓盐酸发生如下反应(杂质不参与反应)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,制得22.4L Cl2(标准状况)。下列有关说法中不正确的是
MnCl2+Cl2↑+2H2O,制得22.4L Cl2(标准状况)。下列有关说法中不正确的是
A.这种软锰矿石中MnO2的质量分数为75%
B.被氧化的HCl的物质的量为4mol
C.参加反应的HCl的质量为146g
D.被还原的MnO2的物质的量为1mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com