
【题目】W、X、Y、Z为原子序数依次递增的短周期主族元素,其中X的某同位素可用于测量文物年代,M为由X元素构成的一种单质。甲和丁两种物质都由W和Y元素组成,乙由Y和Z元素组成,常温下为气体,具有漂白性,戊为二元强酸。它们之间的转化关系如下,下列叙述正确的是( )
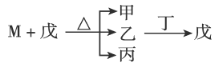
A.气态氢化物的稳定性:X>Y>ZB.原子半径顺序:Z>Y>X>W
C.丁的水溶液适用于医用伤口消毒及环境消毒D.常温常压下,M能和丙发生化合反应
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知可逆反应:X(s)+aY(g)![]() bZ(g);ΔH,反应达到平衡时,温度、压强对可逆反应的影响如右图所示(图中p为压强,其中p1>p2)。下列有关判断正确的是( )
bZ(g);ΔH,反应达到平衡时,温度、压强对可逆反应的影响如右图所示(图中p为压强,其中p1>p2)。下列有关判断正确的是( )
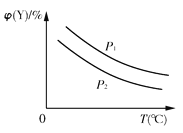
A. 可逆反应的焓变ΔH<0
B. 反应的化学计量数a<b
C. 该可逆反应的平衡常数K=![]()
D. 温度、压强不变,若使用合适的催化剂,可以提高Y的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(ZnS)=l.6×10-24,Ksp(FeS)=6.4×10-18,其中FeS为黑色晶体,ZnS是一种白色颜料的组成成分。下列说法正确的是
A.向物质的量浓度相等的FeSO4和ZnSO4混合液中滴加Na2S溶液,先产生黑色沉淀
B.常温下,反应FeS(s)+Zn2+(aq)ZnS(s)+Fe2+(aq)的平衡常数K=4.0×l06
C.在ZnS的饱和溶液中,加入FeSO4溶液,一定不会产生FeS沉淀
D.向FeS悬浊液中通入少许HC1,c(Fe2+)与Ksp(FeS)均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是 ( )。

A. a为CH4,b为CO2
B. ![]() 向负极移动
向负极移动
C. 此电池在常温时也能工作
D. 正极电极反应式为O2+2CO2+4e-===2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于100mL0.5 mol·L-1Na2CO3溶液,下列有关说法正确的是( )
A.实验室配制该溶液,定容时仰视刻线,所配制溶液浓度偏大
B.该溶液稀释10倍后,c(Na+)=0.05 mol·L-1
C.从该溶液中取出10mL,所取溶液中溶质的物质的量浓度为0.05 mol·L-1
D.该溶液中含有Na2CO3的质量为5.3g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是
A. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=+b kJ/mol
B. C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l);△H=+2b kJ/mol
O2(g)=2CO2(g)+H2O(l);△H=+2b kJ/mol
C. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=-2b kJ/mol
D. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=-4b kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(C1O2)是易溶于水且不与水反应的黄绿色气体,沸点为11℃。某小组在实验室中制备C1O2的装置如下:[已知:SO2+2NaC1O3+H2SO4=2C1O2+2NaHSO4]
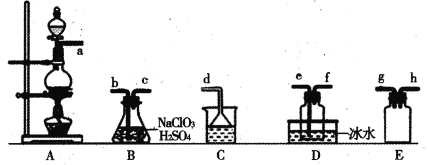
下列说法正确的是
A.连接装置时,导管口a应接h或g,导管口c应接e
B.装置C中装的是饱和食盐水,导管口a通过的气体为SO2
C.装置D放冰水的目的是液化SO2,防止污染环境
D.可选用装置A,用1 mol·L-1盐酸与MnO2反应制取Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据如图所示情况,判断下列说法中正确的是____。
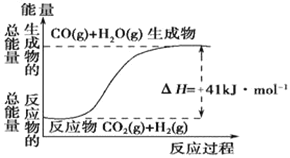
A.其热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g) △H=41kJmol﹣1
B.该反应为吸热反应
C.该反应为放热反应
D.若当H2O为液态时反应热为△H2,则△H2>△H
(2)25℃、101kPa下,已知1g氢气完全燃烧生成液态水时放出142.9kJ的热量,表示氢气燃烧热的热化学方程式是_____。
(3)已知反应:N2(g)+O2(g)=2NO(g) △H1
2H2(g)+O2(g)=2H2O(g) △H2
N2(g)+3H2(g)=2NH3(g) △H3
利用上述三个反应,计算4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H4 的反应焓变为:__(用含△H1、△H2、△H3的式子表示)。
(4)已知反应2HI(g)H2(g)+I2(g)的△H=+11kJmol﹣1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为___kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1L0.1mol/L的Na2CO3溶液中含阴离子总数为0.1NA
B.7.8gNa2O2与过量CO2反应时,转移的电子数为0.2NA
C.2gH218O与D216O的混合物中所含的中子数和电子数均为NA
D.足量乙烷与22.4L(标准状况)Cl2发生取代反应,形成C-Cl键的数目为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com