
【题目】下列分散系中,明显与其他不同的一种是( )
A. 盐酸 B. 稀豆浆 C. NaOH溶液 D. FeCl3溶液
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体)向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是

A. 混合酸中NO3-物质的量为0.4mol
B. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C. 第二份溶液中最终溶质为FeSO4
D. H2SO4浓度为5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计实验制备Ca(NO2)2,实验装置如图所示(夹持装置已略去)。已知:2NO+CaO2==Ca(NO2)2;2NO2+CaO2==Ca(NO3)2。下列说法不正确的是

A. 通入N2是为了排尽装置中的空气
B. 装置B、D中的试剂可分别为水和浓硫酸
C. 将铜片换成木炭也可以制备纯净的亚硝酸钙
D. 借助装置A及氢氧化钠溶液和稀硫酸可以分离CO2和CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
A. 25% B. 50% C. 75% D. 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s)ΔH=-444.3kJ/mol,且熵减小,在常温常压下该反应能自发进行,对反应的方向起决定作用的是
A.焓变B.温度
C.压强D.熵变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列组合正确的是
纯净物 | 混合物 | 电解质 | 非电解质 | |
A | 氨水 | 水煤气 | NaCl | 酒精 |
B | 氢氧化钡 | 蔗糖溶液 | 冰醋酸 | 三氧化硫 |
C | 明矾 | 石灰水 | KOH | 盐酸 |
D | 硫酸 | 钛合金 | 氯化钠 | 氮气 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两等份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(己知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是( )
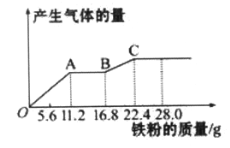
A. 第二份溶液中最终溶质为FeSO4
B. 原混合酸中NO3-物质的量为0.4mol
C. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
D. 取20 mL原混合酸加水稀释至1 L后溶液c(H+) =0.1mol L-l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种主族元素在周期表中的位置如下
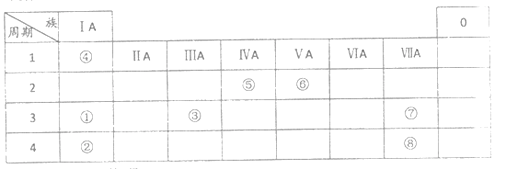
根据上表回答下列问题:
(1)⑥元素的氢化物是_________ (填化学式)
(2)①③⑦三种元素原子半径由大到小的顺序是_________(填元素符号)。
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为_________,该元素在周期表中的位置是__________________。
(4)①②③三种元素氧化物对应水化物碱性最强的是_________(填化学式),①与水反应的化学方程式为_________。
(5)⑦非金属性强于⑧,从原子结构的角度解释其原因:_________。下列表述中能证明这一事实的是_________ (填序号)
a.⑦的氢化物比⑧的氢化物稳定
b.⑦最高价氧化物的水化物的酸性强于⑧最高价氧化物的水化物的酸性
c.⑦能将⑧从其钠盐溶液中置换出来
(6)④与⑤元素形成的分子可能是_________ (填字母序号)
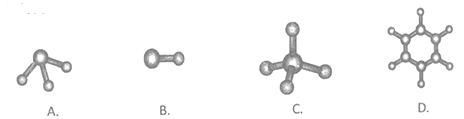
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关原电池的说法不正确的是( )
A.是一种将化学能转换成电能的装置B.较活泼的金属做电池的负极
C.电池负极发生氧化反应D.溶液中阴离子移向正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com