
【题目】人体内有20多种微量元素,它们的质量总和不到体重的千分之一,但是对人体的健康却起着重要作用.下列各组元素全部是微量元素的是( )
A. Na、K、Cl、S、O B. Mo、Mn、Fe、Zn、Cu
C. N、H、O、P、C D. Ge、Ca、Cu、Mg、C
科目:高中化学 来源: 题型:
【题目】在含c(NH4Cl)=3c(AlCl3)的溶液中滴加稀NaOH溶液。下列离子方程式不符合实际情况的是( )
A. Al3++3NH![]() +6OH-===Al(OH)3↓+3NH3·H2O
+6OH-===Al(OH)3↓+3NH3·H2O
B. 2Al3++NH![]() +7OH-===2Al(OH)3↓+NH3·H2O
+7OH-===2Al(OH)3↓+NH3·H2O
C. Al3++3NH![]() +7OH-===AlO
+7OH-===AlO![]() +3NH3·H2O+2H2O
+3NH3·H2O+2H2O
D. Al3++5NH![]() +9OH-===5NH3·H2O+AlO
+9OH-===5NH3·H2O+AlO![]() +7H2O
+7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 NA表示阿伏加德罗常数的值,下列叙述正确的是(
A. 常温常压下,含有 NA个氮原子的氮气体积约为 11.2L
B. 标准状况下,64gSO2中含有的原子数为 3NA
C. 在常温常压下,11.2L Cl2含有的分子数为 0.5NA
D. 标准状况下,11.2L H2O 含有的分子数为 0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国里昂的科学家发现一种只由四个中子组成的微粒,这种微粒称为“四中子”,也有人称之为“零号”元素。它与天体中的中子星构成类似。有关该微粒说法正确的是
A. 该微粒不显电性 B. 该微粒的质量数为2
C. 在元素周期表中与氢元素占同一位置 D. 它与普通中子互称同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴可用于指示剂和催化剂的制备.用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取COC2O42H2O工艺流程如下:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是 .
(2)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀.试用离子方程式和必要的文字简述其原理:_________
(3)萃取剂对金属离子的萃取率与pH的关系如右图1.萃取剂的作用是 ;其使用的适宜pH范围是 .
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(4)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10﹣11、Ksp(CaF2)=1.05×10﹣10,当加入过量NaF后,所得滤液![]() = .
= .
(5)已知:NH3H2O![]() NH4++OH﹣ Kb=1.8×10﹣5;
NH4++OH﹣ Kb=1.8×10﹣5;
H2C2O4![]() H++HC2O4﹣ Ka1=5.4×10﹣2;
H++HC2O4﹣ Ka1=5.4×10﹣2;
HC2O4﹣![]() H+C2O42﹣ Ka2=5.4×10﹣5
H+C2O42﹣ Ka2=5.4×10﹣5
则该流程中所用(NH4)2C2O4溶液的pH 7(填“>”或“<”或“=”)
(6)CoC2O42H2O热分解质量变化过程如图2所示(其中600℃以前是隔绝空气加热,600℃以后是在空气中加热);A、B、C均为纯净物;C点所示产物的化学式是_____________________


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等.
(1)磷的某种核素中,中子数比质子数多1,则表示该核素的原子符号为 .
(2)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中(约1550℃)下通过下面两个反应共熔得到.
①2Ca3(PO4)2(s)+5C(s)═6CaO(s)+P4(s)+5CO2(g)△H1=+Q1kJmol﹣1
②CaO(s)+SiO2(s)═CaSiO3(s)△H2=﹣Q2kJmol﹣1
写出电炉中发生总反应的热化学方程式 .
(3)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:2Ca3(PO4)2+6SiO2=6CaSiO3+P4O10;10C+P4O10=P4↑+10CO↑,上述反应中的各种物质,属于酸性氧化物的有 .
(Ⅱ)离子交换膜是一类具有离子交换功能的高分子材料.一容器被离子交换膜分成左右两部分,如右图所示.若该交换膜为阳离子交换膜(只允许阳离子自由通过),左边充满盐酸酸化的H2O2溶液,右边充满滴有KSCN溶液的FeCl2溶液(足量),一段时间后右边可观察到的现象: ,若该交换膜为阴离子交换膜(只允许阴离子自由通过),左边充满含2mol NH4Al(SO4)2的溶液,右边充满含3mol Ba(OH)2的溶液,当有2mol SO42﹣通过交换膜时(若反应迅速完全),则左右两室沉淀的物质的量之比为 .
![]()
(Ⅲ)某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,利用相关工艺可进行提纯与综合利用.通入一定量的N2后,在1500℃下与Cl2充分反应得到纯化石墨与气体混合物,然后降温至80℃,分别得到不同状态的两类物质a和b.(注:石墨中氧化物杂质均转变为相应的氯化物,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃.)
(1)若a与过量的NaOH溶液反应,可得两种盐,其中一种盐的水溶液具有粘合性,化学反应方程式为 .
(2)若b与过量的NaOH溶液充分反应后,过滤,所得滤液中阴离子有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某恒温恒容的密闭容器内发生反应:2A(g)+B(g)![]() C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是
C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是
A. 再充入2mol A,平衡正移,A的转化率增大
B. 如果升高温度,C的体积分数增大
C. 如果增大压强,化学平衡一定向正反应方向移动,B的体积分数减小
D. 再充入1mol C,C的物质的量浓度将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁铵[aFe2(SO4)3·b(NH4)2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。
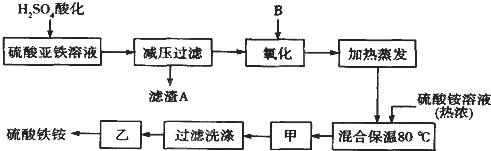
请回答下列问题:
(1)硫酸亚铁溶液加H2SO4酸化的主要目的是 。
(2)下列物质中最适合的氧化剂B是 。
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
(3)操作甲的名称是:甲 。
(4)上述流程中,氧化之后和加热蒸发之前,需取少量 (填试剂的化学式)检验Fe2+是否已全部被氧化;
(5)称取14.00 g所得样品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14 g沉淀;向另一份溶液中加入0.05 mol Ba (NO3)2溶液,恰好完全反应。则该硫酸铁铵的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜和镁的合金2.14g完全溶于一定浓度的硝酸,若反应中硝酸被还原为NO2、NO、N2O三种气体而且在标准状况下它们的体积均为0.224 L。在反应后的溶液中,加入足量的氢氧化钠溶液,生成的沉淀经过滤、洗涤、低温干燥后称量,质量为( )
A.4.18g B.3.12g C.4.68g D.5.08g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com