
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: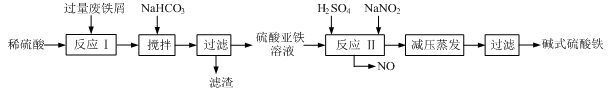
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)使硫酸充分反应掉、提高硫酸利用率或使Fe3+尽可能转化为Fe2+(2分,答对一点即可得2分,其它合理答案也可) Fe2 +、Al3+(2分); 3HCO3-+Al3+ =3CO2↑ + Al(OH)3↓ (2分)
(2)作氧化剂并且可减少污染性气体的排放(其他合理答案也可,1分)
(3)[Fe(OH)]2++2H2O Fe(OH)3 + 2H+ (2分)
Fe(OH)3 + 2H+ (2分)
(4)253.5 (2分)
解析试题分析:(1)把废铁屑加入稀硫酸中,所以其作用为:使硫酸充分反应掉或提高硫酸利用率或使Fe3+尽可能转化为Fe2+;废铁屑还含有Al2O3,所以与H2SO4反应后的溶液含Fe2 +、Al3+;加入NaHCO3后与Al3+发生相互促进的水解反应:3HCO3-+Al3+ =3CO2↑ + Al(OH)3↓。
(2)NaNO2氧化Fe2+会生成NO,造成污染,而O2氧化Fe2+产物无污染,所以O2的作用为:作氧化剂并且可减少污染性气体的排放。
(3)[Fe(OH)]2+结合H2O电离的OH?生成Fe(OH)3,离子方程式为:[Fe(OH)]2++2H2O Fe(OH)3 + 2H+
Fe(OH)3 + 2H+
(4)根据Fe元素守恒可知:Fe ~ Fe(OH)SO4 100吨废铁屑理论上可生成碱式硫酸铁的质量为:100×84.0%÷56×169=253.5吨。
考点:本题考查试剂的用途、产物的判断与产量的计算、离子方程式的书写。


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:填空题
阅读以下内容,回答问题。
冶炼金属一般有下列四种方法:①焦炭法;②水煤气(或H2,或CO)法;③活泼金属置换法;④电解法。四种方法各有优缺点,在工业上均有应用。
(1)一种无色气体A与红热的炭反应,得到另一种无色气体B,B与灼热的氧化铜反应,又得到A,则A、B分别为_______(填序号)。
A.O2、CO2 B.O2、CO C.CO2、CO D.CO、CO2
(2)下列说法错误的是_______(填序号)。
A.对废旧金属的最好处理方法是回收再利用
B.提炼金属要经过矿石的富集、冶炼、精炼三步
C.活泼金属的冶炼都是通过电解其盐溶液制得
D.热还原法中还原剂有焦炭、一氧化碳、氢气或活泼金属等
(3)钛(Ti)有“未来钢铁”之称。工业上常以:TiCl4+2Mg Ti+2MgCl2获得海绵状钛。该反应在下列哪种环境中进行_______ (填序号)。
Ti+2MgCl2获得海绵状钛。该反应在下列哪种环境中进行_______ (填序号)。
A.稀有气体中 B.空气中 C.氮气中 D.CO2气体中
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收。请回答下列问题:
(1)煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥后进入 (填设备名称),其主要目的是 。
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如图1)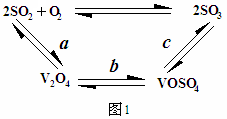
其中a、c二步反应的化学方程式可表示为: 、 。
(3)550℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(P)的关系如图2所示,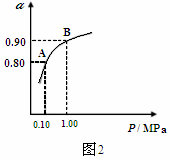
则:将2.0mol SO2和1.0mol O2置于5L密闭容器中,反应达平衡后,体系总压强为0.10M Pa,A与B表示不同压强下的SO2转化率,通常情况下工业生产中采用常压的原因是: 。
(4)为循环利用催化剂,科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣,查阅资料知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水。该工艺的流程如图如下: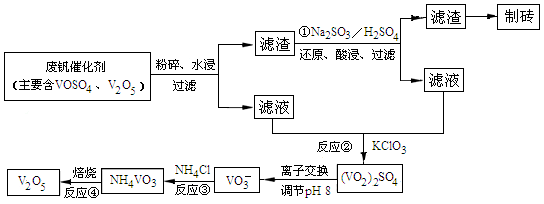
则反应①②③④中属于氧化还原反应的是 (填数字序号),反应①的离子方程式为 ,该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图试建议控制氯化铵系数和温度: 、 。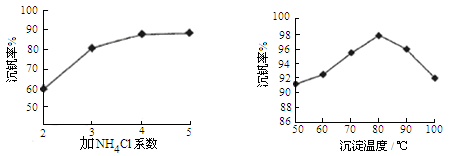
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下,回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成。副产品甲俗称“绿矾”其化学式是________________。
(2)上述生产流程中加入Fe屑的目的是 (用离子方程式表示),检验副产品甲是否变质的实验方法是 。
(3)上述生产流程中所得到的金属钛中混有少量杂质,可加入 溶解后除去。
(4)溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
丙酸的结构为CH3—CH2—COOH,丙酸盐是安全有效的防霉、防腐剂,一种以碱式碳酸锌为原料的生产工艺流程如下:
| 序号 | n(丙酸)∶ n(碱式碳酸锌) | 反应温度/℃ | 丙酸锌产率/% |
| 1 | 1∶0.25 | 60 | 67.2 |
| 2 | 1∶0.25 | 80 | 83.5 |
| 3 | 1∶0.25 | 100 | 81.4 |
| 4 | 1∶0.31 | 60 | 89.2 |
| 5 | 1∶0.31 | 80 | 90.1 |
| 6 | 1∶0.31 | 100 | 88.8 |
 ,反应温度 ℃。
,反应温度 ℃。 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫酸亚锡(SnSO4)可用于镀锡工业.某小组设计SnSO4制备路线为: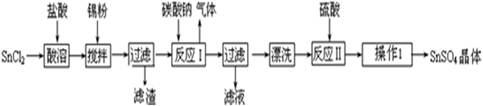
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化.
Ⅱ.SnCl2易水解生成碱式氯化亚锡
(1)锡原子的核电荷数为50,与碳元素同处ⅣA族,锡位于周期表的第 周期(1分)
(2)操作Ⅰ是 过滤、洗涤等(2分)
(3)溶解SnCl2粉末需加浓盐酸,原因是
(4)加入Sn粉的作用有两个:①调节溶液pH ②
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是
(6)酸性条件下,SnSO4与双氧水去反应的离子方程式是
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn+2HCl═SnCl2+H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定②生成的Fe2+,再计算锡粉的纯度,请配平方程式:
FeCl2 + K2Cr2O7 + HCl = FeCl3 + KCl + CrCl2+ 
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二氧化钛广泛应用于各类结构表面涂料、纸张涂层等,二氧化钛还可作为制备钛单质的原料。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:TiCl4水解生成TiO2·xH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2,此方法制备得到的是纳米二氧化钛。
(1)① TiCl4水解生成TiO2·x H2O的化学方程式为_______________________________;
② 检验TiO2·x H2O中Cl-是否被除净的方法是______________________________。
方法2:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下:
(2)Fe2O3与H2SO4反应的离子方程式是 。
(3)甲溶液中除含TiO2+之外还含有的金属阳离子有 。
(4)加Fe的作用是 。
Ⅱ.二氧化钛可用于制取钛单质
(5)TiO2制取单质Ti,涉及到的步骤如下:
反应②的方程式是 ,该反应需要在Ar气氛中进行,请解释原因:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过“中温焙烧—钠氧化法”回收Na2Cr2O7等物质。
已知:水浸后溶液中存在Na2CrO4、NaAlO2、Na2ZnO2等物质
(1)水浸后的溶液呈____性(“酸”、“碱”、“中”)。
(2)完成氧化焙烧过程中生成Na2CrO4的化学方程式:
____Cr(OH)3+____Na2CO3+_____  = ____Na2CrO4+___CO2+_____
= ____Na2CrO4+___CO2+_____
(3)滤渣II的主要成分有Zn(OH)2、___________________________________。
(4)“系列操作”中为:继续加入H2SO4,________冷却结晶,过滤。继续加入H2SO4目的是________________________。
已知:①除去滤渣II后,溶液中存在如下反应:2CrO42ˉ+2H+ Cr2O72ˉ+H2O
Cr2O72ˉ+H2O
②Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表
| 温度 化学式 | 20℃ | 60℃ | 100℃ |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7 | 183 | 269 | 415 |
| Na2CrO4 | 84 | 115 | 126 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列物质的工业制备原理的方程式书写正确的是
A.氢氧化钠:Na2CO3+Ca(OH)2 CaCO3↓+2NaOH CaCO3↓+2NaOH |
B.乙醇:C6H12O6 2C2H5OH+2CO2↑ 2C2H5OH+2CO2↑ |
C.二氧化硫:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O CuSO4+SO2↑+2H2O |
D.氯气:Ca(ClO)2+4HCl(浓) CaCl2+2Cl2↑+2H2O CaCl2+2Cl2↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com