
| A. | 冰毒、黄连素 | B. | 海洛因、麻黄碱 | C. | 大麻、摇头丸 | D. | 黄曲霉素、尼古丁 |
分析 毒品是指鸦片、海洛因、甲基苯丙胺(冰毒)、吗啡、大麻、可卡因以及国家规定管制的其他能够使人形成瘾癖的麻醉药品和精神药品,据此分析.
解答 解:A.冰毒即“甲基苯丙胺”,外观为纯白结晶体,故被称为“冰”,对人体中枢神经系统具有极强的刺激作用,且毒性强烈,属于毒品;黄连素是一种重要的生物碱,用于治疗细菌性痢疾和肠胃炎,它无抗药性和副作用,则不是毒品,故A错误;
B.麻黄碱有显著的中枢兴奋作用,是国际奥委会严格禁止使用的兴奋剂,但不是毒品,故B错误;
C、大麻类毒品主要活性成分是四氢大麻酚,对中枢神经系统有抑制、麻醉作用,吸食后产生欣快感,有时会出现幻觉和妄想,长期吸食会引起精神障碍、思维迟钝,并破坏人体的免疫系统,是毒品;摇头丸是冰毒的衍生物,以MDMA等苯丙胺类兴奋剂为主要成分,具有兴奋和致幻双重作用,服用后会产生中枢神经强烈兴奋,出现摇头和妄动,在幻觉作用下常常引发集体淫乱、自残与攻击行为,并可诱发精神分裂症及急性心脑疾病,精神依赖性强,则是毒品,故大麻和摇头丸都是毒品,故C正确;
D、黄曲霉素是由黄霉菌产生的真菌霉素,是目前发现的化学致癌物中最强的物质之一,主要损害肝脏功能并有强烈的致癌、致畸、致突变作用,能引起肝癌,还可以诱发骨癌、肾癌、直肠癌、乳腺癌、卵巢癌等,是有害物质,但不属于毒品,故D错误.
故选C.
点评 本题考查学生对毒品的认识,题目难度不大,学生应明确常见的毒品及其对人类健康的危害,并做到珍爱生命、远离毒品.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该硫酸试剂的物质的量浓度为18.4 | |
| B. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% | |
| C. | 配制50.0mL4.6mol•L-1的稀硫酸需取该硫酸12.5mL | |
| D. | 2.4gMg与足量的该硫酸反应得到H2 的体积为2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| H2(g) | N2(g) | NH3(g) | |
| 1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 946 | a |
| A. | 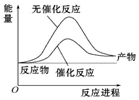 如图可表示合成氨过程中的能量变化 | |
| B. | a的数值为391 | |
| C. | Q1的数值为92 | |
| D. | 相同条件下,反应物若为2 mol N2和6 mol H2,放出热量Q2>2Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com