
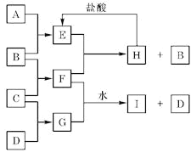
【题目】A、B、C、D是按原子序数由小到大排列的前20号元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1:2。在一定条件下,各物质之间的相互转化关系如右(部分产物未列出):
(1)A是_____,C是______ (填元素名称)。
(2)H与盐酸反应生成 E 的化学方程式是_________。
(3)E与F反应的化学方程式是___________。
(4)F与G的水溶液反应生成I和D的离子方程式是_____________。
【答案】碳 钠 Na2CO3+2HCl=2NaCl+H2O+CO2↑ 2CO2+2Na2O2=2Na2CO3+O2 Na2O2+S2-+2H2O=4OH-+S↓+2Na+
【解析】
单质B和C反应生成F,F的焰色反应呈黄色,说明F是钠的化合物,而F是单质B、C化合而成,B、E均为组成空气的成分,故C为金属钠;G是单质C、D化合而成,原子个数比为D:C=1:2,则G中D元素为-2价,且原子序数D>C,故D为硫,G为Na2S;B为单质且为组成空气的成分,还可与钠反应,最易想到是O2,如B为O2,E也为组成空气的成分,由条件分析E只能是CO2,A即为碳,由题中反应关系可知F是Na2O2,据此分析解答。
由分析可知,A、B、C、D分别是:C、O2、Na、S四种单质。
(1)由分析可知,A是碳,C是钠;
(2)A、B是C、O2,反应生成CO2,B、C是O2、Na,反应生成Na2O2,CO2与Na2O2反应生成H和O2,H为Na2CO3,Na2CO3与盐酸反应生成E(二氧化碳)的化学方程式是Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(3)由分析可知E与F分别是CO2与Na2O2,二者反应的化学方程式是2CO2+2Na2O2=2Na2CO3+O2;
(4))F与G分别是Na2O2与Na2S,Na2O2具有强氧化性,将硫从-2价氧化为0价,根据得失电子守恒、电荷守恒,Na2O2与Na2S反应的离子方程式是:Na2O2+S2-+2H2O=4OH-+S↓+2Na+。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】三氯胺(![]() )是一种饮用水二级消毒剂,可由以下反应制备:Ⅰ.
)是一种饮用水二级消毒剂,可由以下反应制备:Ⅰ.![]()
![]() 。回答下列问题:
。回答下列问题:
(1)已知:Ⅱ.![]()
![]() Ⅲ.
Ⅲ.![]()
![]() ,则
,则![]() ________(用含
________(用含![]() 和
和![]() 的代数式表示)。
的代数式表示)。
(2)向容积均为2 L的甲、乙两个恒温密闭容器中分别加入![]() 和
和![]() ,发生反应Ⅰ,测得两容器中
,发生反应Ⅰ,测得两容器中![]() 随反应时间的变化情况如下表所示:
随反应时间的变化情况如下表所示:
时间/min | 0 | 40 | 80 | 120 | 160 |
容器甲( | 4.0 | 3.0 | 2.2 | 1.6 | 1.6 |
容器乙( | 4.0 | 2.9 | 2.0 | 2.0 | 2.0 |
①0~80 min内,容器甲中![]() ________。
________。
②反应Ⅰ的![]() ________0(填“>”或“<”),其原因为________________________。
________0(填“>”或“<”),其原因为________________________。
③关于反应Ⅰ,下列说法正确的是________(填选项字母)。
a.容器内![]() ,说明反应达到平衡状态
,说明反应达到平衡状态
b.容器内气体密度不变,说明反应达到平衡状态
c.达平衡后,加人一定量![]() ,平衡逆向移动
,平衡逆向移动
d.达平衡后,按原投料比再充入一定量反应物,平衡后![]() 的转化率增大
的转化率增大
④温度为![]() 时HCl(g)的平衡体积分数=________,该温度下,若改为初始体积为2 L的可变容器,平衡时容器中
时HCl(g)的平衡体积分数=________,该温度下,若改为初始体积为2 L的可变容器,平衡时容器中![]() ________(填“>”“=”或“<”)1.6 mol。
________(填“>”“=”或“<”)1.6 mol。
⑤温度为![]() 时,该反应的平衡常数
时,该反应的平衡常数![]() ________。
________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有8种物质:①甲烷 ②苯 ③聚乙烯 ④聚异戊二烯(![]() ) ⑤2-丁炔 ⑥环乙烷 ⑦邻二甲苯 ⑧2-甲基-1,3-丁二烯,既能使酸性高锰酸钾溶液褪色,又能与溴水反应使之褪色的是
) ⑤2-丁炔 ⑥环乙烷 ⑦邻二甲苯 ⑧2-甲基-1,3-丁二烯,既能使酸性高锰酸钾溶液褪色,又能与溴水反应使之褪色的是
A. ③④⑤⑧ B. ④⑤⑦⑧ C. ④⑤⑧ D. ③④⑤⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,请用化学用语回答下列问题:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
(1)在③~⑦元素中,原子半径最大的是__________(填元素符号);
(2)⑦元素的最高价氧化物对应的水化物与其氢化物能生成盐M,M中含有的化学键类型有__________________;
(3)写出元素①和⑧的单质在加热条件下反应生成的化合物的电子式:_________。
(4
(5)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是_____________(填物质化学式);呈两性的氢氧化物是_________(填物质化学式),该化合物与NaOH溶液反应的离子方程式为___________。
(6)用电子式表示元素③与⑨形成化合物的过程_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g)达到平衡,下列说法正确的是( )
CH3OH(g)达到平衡,下列说法正确的是( )
容器 | 温度/K | 物质的起始浓度/mol·L-1 | 物质的平衡浓度/mol·L-1 | ||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
Ⅱ | 400 | 0.40 | 0.20 | 0 | |
Ⅲ | 500 | 0.20 | 0.10 | 0 | 0.025 |
A. 该反应的正反应放热
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C. 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D. 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固定容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
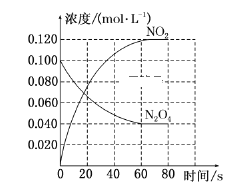
(1)反应的ΔH________(填“大于”或“小于”)0;100 ℃时,体系中各物质浓度随时间变化如上图所示。在0~60 s时段,反应速率v(N2O4)为______________________________。
(2)100 ℃时达到平衡后,改变反应温度为T,c(N2O4)降低,经10 s又达到平衡。
①T________(填“大于”或“小于”)100 ℃,判断理由是_____________________;
②100 ℃时达到平衡后,向容器中再充入0.20 mol NO2气体,新平衡建立后,NO2的体积分数________(填“增大”“不变”或“减小”)。
(3)温度T时反应达平衡后,将反应容器的容积减小一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及结论都正确的是
选项 | 实验 | 现象 | 结论 |
A | 碘酒滴到土豆片上 | 土豆片变蓝 | 淀粉遇碘元素变蓝 |
B | 大试管中CH4和Cl2按照1∶1混合,放于光亮处 | 试管内气体颜色变浅,试管壁出现油状液滴,管中有白雾 | 光照条件下,CH4和Cl2发生了化学变化 |
C | 向20%蔗糖溶液中加入少量稀硫酸,加热,再加入新制氢氧化铜后再加热至沸腾 | 无明显现象 | 蔗糖未发生水解 |
D | 小块鸡皮上滴加3~5滴浓硝酸 | 鸡皮由白变黄 | 蛋白质都能发生颜色变化 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】山梨酸是应用广泛的食品防腐剂,其分子结构如图所示。下列说法错误的是
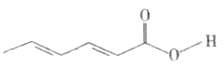
A.山梨酸的分子式为C6H8O2
B.1 mol山梨酸最多可与2 mol Br2发生加成反应
C.山梨酸既能使稀KMnO4酸性溶液褪色,也能与醇发生置换反应
D.山梨酸分子中所有碳原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,少量碳及二氧化硅)为原料制备的流程如下:
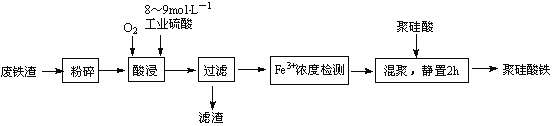
(1)废铁渣进行“粉碎”的目的是____________。
(2)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等,其中酸浸温度对铁浸取率的影响如右图所示:
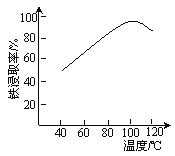
①加热条件下酸浸时,Fe3O4与硫酸反应的化学方程式为___________。
②酸浸时,通入O2的目的是_____________,该反应的离子方程式为_________。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是____________。
(3)滤渣的主要成分为____________(填化学式)。
(4)“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com