
常温下,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液。有关微粒的物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)根据下图图示判断,下列说法错误的是( )

A.当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HAˉ)>c(H+)> c(A2-)>c(OHˉ)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水的大
C.NaHA溶液中:c(OH-)+c(A2–)=c(H+)+c(H2A)
D.向Na2A溶液加入水的过程中,pH减小
B
【解析】
试题分析:A.当V(NaOH)=20 mL时,发生反应为NaOH+H2A=NaHA+H2O,溶液主要为NaHA,由图可知c(A2-)>c(H2A),说明HA-电离大于水解程度,溶液显酸性,则c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),正确;B.由图示关系知,c(A2-)>c(H2A),说明电离大于水解程度,溶液显酸性,水的电离受到了抑制,错误;C.根据电荷守恒得c(OH-)+2c(A2-)+c(HA-)=c(H+)+c(Na+),根据物料守恒得c(Na+)=c(HA-)+c(H2A)+c(A2-),所以得c(OH-)+c(A2-)=c(H+)+c(H2A),正确;D.Na2A溶液加水稀释,促进其水解,但溶液中氢氧根离子浓度减小,所以溶液的pH减小,正确,答案选B。
考点:考查酸碱混合计算,离子浓度的大小比较,盐的水解的应用,水的电离,守恒规律的应用


科目:高中化学 来源:2013-2014北京市大兴区高三统一练习理综化学试卷(解析版) 题型:实验题
(12分)天然水是人类饮用水的主要来源。从天然水获得可以饮用的水一般须经过沉降悬浮物、杀菌消毒等步骤。
(1)沉降悬浮物要在水中加入絮凝剂,如将铝盐加入水中能达到净水目的,
原因是 (用离子方程式表示)。
(2)氯气可用于自来水杀菌消毒剂,结合离子方程式和文字理由 。
(3)新型水处理剂高铁酸钾 (K2FeO4)具有强的氧化作用和絮凝作用。工业上可通过以下流程制备高铁酸钾:
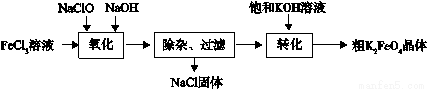
查阅资料:高铁酸盐在中性或酸性溶液中会逐渐分解,在碱性溶液中稳定。
完成“氧化”过程中的离子方程式
□Fe3+ + □ClO- +□ =□ FeO42- + □Cl- + □
“转化”过程中实现由Na2FeO4制得K2FeO4,是利用二者 性的不同。
③结合资料完成粗K2FeO4晶体的提纯:将粗产品用 溶解,然后再加入饱和KOH溶液、冷却结晶、过滤。
④高铁酸钾的应用还在不断扩展中。如可制成高铁电池, 电池反应为:
3Zn + 2K2FeO4 + 8H2O  3Zn(OH)2 + 2Fe(OH)3 + 4KOH
3Zn(OH)2 + 2Fe(OH)3 + 4KOH
放电时,正极反应为: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市东城区高三二模理综化学试卷(解析版) 题型:选择题
下图是制备和研究乙炔的性质实验装置图。下列说法不正确的是

A. 制备乙炔的反应原理是CaC2+2H2O 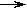 Ca(OH) 2+C2H2↑
Ca(OH) 2+C2H2↑
B. c的作用是除去影响后续实验的杂质
C. d中的有机产物与AgNO3溶液混合能产生沉淀
D. e中的现象说明乙炔能被高锰酸钾酸性溶液氧化
查看答案和解析>>
科目:高中化学 来源:2013-2014内蒙古鄂尔多斯市高一下学期期末质量检测化学试卷(解析版) 题型:选择题
在一定温度下,反应A2(g)+B2(g)  2AB(g)达到反应限度的标志是
2AB(g)达到反应限度的标志是
A.容器内气体的总压强不随时间变化而变化
B.A2和B2物质的量之和与AB的物质的量相等
C.c(A2):c(B2):c(AB)=1:1:2
D.A2、B2和AB的物质的量不再改变
查看答案和解析>>
科目:高中化学 来源:2013-2014内蒙古赤峰市高三下学期4月统一考试理综化学试卷(解析版) 题型:填空题
[化学—选修3:物质结构与性质](15分)
有A、B、C、D、E、F、G、H原子序数递增的前四周期八种元素。请根据下列信息,回答问题:
①A、B、C、D、E、F为短周期主族元素,原子半径大小关系为A<D<C<B<F<E; |
②A与D形成的化合物常温下为液态; |
③B元素原子价电子(外围电子)排布为nSnnPn |
④F元素原子的核外p电子总数比s电子总数多1; |
⑤第一电子能:F<E; |
⑥G的基态原子核外有6个未成对电子; |
⑦H能形成红色(或砖红色)的 |
(1)G元素基态原子的价电子排布图为 。
(2) 中B原子采取的杂化轨道类型为 。
中B原子采取的杂化轨道类型为 。
(3)根据等电子体原理,推测 分子的空间构型为 。
分子的空间构型为 。
(4)下列有关E、F的叙述正确的是( )
a.离子半径E>F b.电负性E<F
c.单质的熔点E>F d. E、F的单质均能与氧化物发生置换
e. E的氧化物具有两性 f. E、F均能与氯元素构成离子晶体
(5) 极易溶于
极易溶于 ,原因是 。
,原因是 。
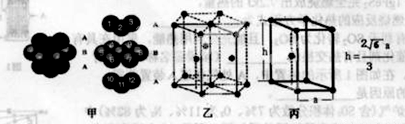
(6)E单质的晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,晶胞如下图丙所示。则E单质的晶体堆积模型为 。
若已知E原子半径为r pm, 表示阿伏伽德罗常数,晶胞的边长为a。晶胞的高为h,则晶胞的密度可表示为 g/cm3。(用只含r和
表示阿伏伽德罗常数,晶胞的边长为a。晶胞的高为h,则晶胞的密度可表示为 g/cm3。(用只含r和 代数式表示)
代数式表示)
查看答案和解析>>
科目:高中化学 来源:2013-2014内蒙古赤峰市高三下学期4月统一考试理综化学试卷(解析版) 题型:选择题
设NA代表阿伏伽德罗常数的述职,下列说法中正确的是( )
A.在标准状况下,33.6LSO3中含有的氧原子数是4.5NA
B。两份均为2.7g的铝样品分别为100mL浓度均为2mol·L-1的盐酸和氢氧化钠溶液充分反应,转移的电子数均为0.3 NA
C.常温常压下,agC2H4和C3H6的混合气体中所含共用电子对数目为3a/14·NA
D.6.0g金刚石中含有的共价键数为2 NA
查看答案和解析>>
科目:高中化学 来源:2013-2014内蒙古赤峰市年宁城县高三5月模拟考试理综化学试卷(解析版) 题型:选择题
下图是一种燃料型电池检测仪的工作原理示意图。下列说法不正确的是 ( )

A.该仪器工作时酒精浓度越大,则电流强度越大
B.工作时处电路电子流向为X→Y
C.检测结束后,X极区的pH增大
D.电池总反应为2CH3CH2OH+O2=2CH3CHO+2H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省红河州高三下学期毕业生复习统一检测理综化学试卷(解析版) 题型:选择题
如图是立方烷的球棍模型, 下列有关说法不正确的是
下列有关说法不正确的是
A.其一氯代物只有一种同分异构体
B.其二氯代物有三种同分异构体
C.它的分子式不符合CnH2n+2,所以它不是饱和烃
D.它与苯乙烯(C6H5—CH=CH2)互为同分异构体
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高三5月校统测理科综合化学试卷(解析版) 题型:选择题
下列化合物的核磁共振氢谱中出现三组峰的是
A.2,2,3,3?四甲基丁烷 B.2,3,4?三甲基戊烷
C.3,4?二甲基己烷 D.2,5?二甲基己烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com