
| A、0.5mol/L |
| B、2mol/L |
| C、2.25mol/L |
| D、3mol/L |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 0.6mol |
| 0.2L |


科目:高中化学 来源: 题型:
| A、检验买来的奶粉中是否加有淀粉 |
| B、检验自来水中是否含有Cl- |
| C、除去保温瓶中的水垢 |
| D、洗去白色衣服上的番茄汁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
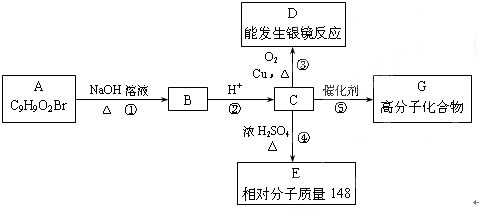
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3,3-二甲基-4-乙基戊烷 |
| B、(CH3)2CHCH=CH2 3-甲基丁烯 |
C、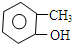 邻甲基苯酚 邻甲基苯酚 |
| D、CH2Cl-CH2Cl 二氯乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
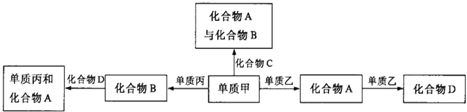
| A、上述转化关系所涉及的化合物中有一种是酸性氧化物 |
| B、甲、乙、丙三种单质的晶体一定是分子晶体 |
| C、上图所示的五个转化关系中,有三个是化合反应 |
| D、上图所示的五个转化关系中,均为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com