
【题目】化学实验是化学学习的重要内容。根据你掌握的知识,完成下面内容。
![]() 实验室需要配制0.1 mol·L-1NaOH溶液230mL,请回答下列问题:
实验室需要配制0.1 mol·L-1NaOH溶液230mL,请回答下列问题:
![]() 应选择____mL的容量瓶,用天平称取____g NaOH。
应选择____mL的容量瓶,用天平称取____g NaOH。
![]() 溶解NaOH后的溶液需冷却到室温后方能转移入容量瓶中。若趁热转移会使溶液的浓度______(填“偏大”或“偏小”,下同);在洗涤烧杯和玻璃棒的过程中,每次洗涤液均需注入容量瓶,不能损失点滴液体,否则会导致溶液的浓度______。
溶解NaOH后的溶液需冷却到室温后方能转移入容量瓶中。若趁热转移会使溶液的浓度______(填“偏大”或“偏小”,下同);在洗涤烧杯和玻璃棒的过程中,每次洗涤液均需注入容量瓶,不能损失点滴液体,否则会导致溶液的浓度______。
![]() 有人认为,用这种方法只能配置0.1 mol·L-1的NaOH溶液,而无法得到0.1000 mol·L-1的NaOH溶液,你觉得他的理由是__________________________________________。
有人认为,用这种方法只能配置0.1 mol·L-1的NaOH溶液,而无法得到0.1000 mol·L-1的NaOH溶液,你觉得他的理由是__________________________________________。
![]() 选择下列实验方法分离物质,将分离方法的序号填在横线上。
选择下列实验方法分离物质,将分离方法的序号填在横线上。
![]() 萃取分液
萃取分液 ![]() 升华
升华 ![]() 结晶
结晶 ![]() 过滤
过滤 ![]() 蒸馏
蒸馏 ![]() 分液
分液
![]() 分离饱和食盐水与沙子的混合物______;
分离饱和食盐水与沙子的混合物______;
![]() 从硝酸钾和氯化钠的混合液中获得硝酸钾______;
从硝酸钾和氯化钠的混合液中获得硝酸钾______;
![]() 从碘水中提取碘单质______;
从碘水中提取碘单质______;
![]() 分离水和汽油的混合物______;
分离水和汽油的混合物______;
![]() 分离
分离![]() 沸点为
沸点为![]() 和甲苯
和甲苯![]() 沸点为
沸点为![]() 的混合物______。
的混合物______。
【答案】![]()
![]() 偏大 偏小 由于NaOH固体极易潮解,无法精确称取1.000gNaOH固体
偏大 偏小 由于NaOH固体极易潮解,无法精确称取1.000gNaOH固体 ![]() C A F E
C A F E
【解析】
(1)①根据n=cV和m=nM来计算,注意按照配置250mL溶液计算;
②根据c=![]() 来进行误差分析
来进行误差分析
③根据氢氧化钠易潮解的性质分析;
(2)①固液分离,采用过滤的方法;
②氯化钠的溶解度随着温度的升高而变化不大,硝酸钾的溶解度随着温度的升高而增大;
③从碘水中提取碘单质采用萃取分液的方法;
④互不相溶的液体采用分液的方法分离;
⑤互溶且沸点不同的液体采用蒸馏的方法分离.
(1) ①由于无230mL的容量瓶,故选用250mL的容量瓶,配制出250mL的0.1mol/L的溶液,故需要的氢氧化钠的物质的量n=cV=0.1mol/L×0.25L=0.025mol,质量m=nM=0.025mol×40g/mol=1.0g;
答案:250 1.0
②NaOH溶解时放出大量的热,未冷却到室温后转移入容量瓶中,根据热胀冷缩原理,会使定容时加水体积偏小,所得溶液的浓度偏大;在洗涤烧杯和玻璃棒的过程中,每次洗涤液均需注入容量瓶,不能损失点滴液体,否则会导致溶质的损失,溶液的浓度偏小;
答案:偏大 偏小
③由于NaOH固体极易潮解,无法精确称取1.000gNaOH固体,所以无法配置0.1000 mol·L-1的NaOH溶液;
答案:由于NaOH固体极易潮解,无法精确称取1.000gNaOH固体
(2)①不溶于水的固体和溶液的分离,采用过滤的方法,故选D;
②硝酸钾和氯化钠都溶于水,但二者在水中的溶解度不同,可用结晶的方法分离,故选C;
③从碘水中提取碘单质采用萃取分液的方法,故选A;
④汽油和水不互溶,二者混合分层,所以可以采用分液的方法分离,故选F;
⑤四氯化碳和甲苯互溶且属于沸点不同的液体,所以可以采用蒸馏的方法分离,故选E;
答案:![]() C A F E
C A F E


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】硼位于ⅢA族,三卤化硼是物质结构化学的研究热点,也是重要的化工原料。三氯化硼(BCl3)可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
[查阅资料] ①BCl3的熔点为-107.3 ℃,沸点为12.5 ℃;②2B+6HCl![]() 2BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
2BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
[设计实验] 某同学设计如图所示装置制备三氯化硼:

请回答下列问题:
(1)常温下,可用高锰酸钾与浓盐酸发生的反应可替代A装置中的反应,请写出高锰酸钾与浓盐酸反应的离子方程式:_______________________________________________。
(2)E装置的作用是________________________________。如果拆去B装置,可能的后果是______________________________________________________________________。
(3)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式______________________________________________________。实验室保存三氯化硼的注意事项是___________________________________。
(4)实验中可以用一个盛装____________________(填试剂名称)的干燥管代替F和G装置,使实验更简便。
(5)为了顺利完成实验,正确的操作是_____(填序号)。
①先点燃A处酒精灯,后点燃D处酒精灯 ②同时点燃A、D处酒精灯 ③先点燃D处酒精灯,后点燃A处酒精灯
(6)请你补充完整下面的简易实验,以验证制得的产品中是否含有硼粉:取少量样品于试管中,滴加浓________________(填化学式)溶液,若有气泡产生,则样品中含有硼粉;若无气泡产生,则样品中无硼粉。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在鉴定还原糖的实验中,加入斐林试剂时,必须要
A. 先加入斐林试剂甲液,后加入乙液
B. 将斐林试剂的甲液和乙液等量混合均匀后再加
C. 先加入斐林试剂乙液,后加入甲液
D. 以上A、B、C三项操作方法都正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家利用下列装置图成功地实现了CO2和H2O合成CH4。下列叙述错误的是

A. 电池工作时,实现了将太阳能转化为电能
B. 铜电极为正极,电极反应式为CO2-8e-+8H+=CH4+2H2O
C. 电池内 H+ 透过质子交换膜从左向右移动
D. 为提高该人工光合系统的工作效率,可向装置中加入少量稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列反应:![]() 设计一个原电池,请选择适当的材料和试剂。
设计一个原电池,请选择适当的材料和试剂。
I.![]() 请写出你选用的正极材料、负极材料、电解质溶液
请写出你选用的正极材料、负极材料、电解质溶液![]() 写化学式
写化学式![]() :正极为_____________ ,电解质溶液:_____________ ;
:正极为_____________ ,电解质溶液:_____________ ;
![]() 负极反应式: ____________________;
负极反应式: ____________________;
![]() 溶液中
溶液中![]() 向 __________ 极移动。
向 __________ 极移动。
II.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
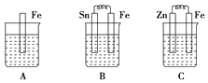
(1)B中Sn极的电极反应式为_________________。
(2)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O35H2O)易溶于水,难溶于乙醇,加热、遇酸均易分解。某实验室模拟工业上制取硫代硫酸钠晶体,反应装置和试剂如下图:
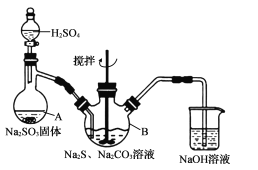
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体较均匀地通人Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。
回答下列问题:
(l)仪器A的名称是____,Na2S的电子式为____。
(2)三颈烧瓶B中制取Na2S203反应的总化学方程式为_______________
(3)从上述生成物混合液中获得较高产率Na2S2O3.5H2O的步骤为
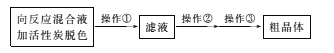
为减少产品的损失,操作①为趁热过滤,“趁热”的目的是____;操作②是____;操作③是抽滤、洗涤、干燥。
(4)测定Na2S203.5H2O纯度取6.00 g产品,配制成100 mL溶液。取10. 00 mL溶液,以淀粉溶液为指示剂,用浓度0. 0500 mol/L的标准溶液进行滴定,反应原理为2S2O32-+I2![]() S4O62-+2I-,相关数据记录如下表所示。
S4O62-+2I-,相关数据记录如下表所示。
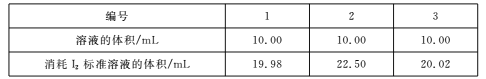
Na2S2035H20的纯度为____%(保留1位小数)。
(5)Na2S2O3常用作脱氯剂,在溶液中易被Cl2氧化成SO42-,该反应的离子方程式为________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com