
【题目】对于甲、乙、丙、丁、戊五种溶液有如下信息:①分别由NH4+、Na+、Al3+、Ba2+、Ag+和NO3-、Cl-、SO42-、Br-、CO32-离子中的各一种组成(不重复)②其中甲丙戊三种溶液呈酸性,乙溶液呈碱性③甲、乙反应生成白色沉淀和气体,丁可分别与甲乙丙反应生成白色沉淀。请回答下列问题:
(1)用化学式表示乙、丁两种物质:乙 丁
(2)用离子方程式表示戊溶液呈酸性的原因 。
(3)检验甲中阴离子的操作方法是 。
【答案】
(1)Na2CO3 BaCl2;
(2)NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
(3)取溶液少许,滴加稀HCl酸化,再滴加BaCl2有白色沉淀生成
【解析】
试题分析:由于Ag+只能和NO3-共存,所以一定有硝酸银;根据③可知,产生得白色沉淀是Al(OH)3,气体是CO2,所以再根据②可知,乙是Na2CO3,甲中含有Al3+;又因为丁可分别与甲、乙、丙反应生成白色沉淀,则丁中含有Ba2+,甲、丙、戊三种溶液呈酸性,丁显中性,所以丁是BaCl2,则甲是Al2(SO4)3,丙是AgNO3,因此戊是NH4Br。
(1)由上述分析可知,乙为Na2CO3,丁为:BaCl2,故答案为:Na2CO3;BaCl2;
(2)NH4Br是强酸弱碱盐,NH4+水解显酸性,离子方程式为:NH4++H2O![]() NH3H2O+H+,故答案为:NH4++H2O
NH3H2O+H+,故答案为:NH4++H2O![]() NH3H2O+H+;
NH3H2O+H+;
(3)检验SO42-时,首先要加入盐酸,以排除CO32-等干扰,然后再加入氯化钡溶液,如果出现白色沉淀,说明含有SO42-,故答案为:首先要加入盐酸,然后再加入氯化钡溶液,如果出现白色沉淀,说明含有SO42-。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.共价化合物中只含共价键
B.离子化合物中可能含有共价键
C.干冰变为二氧化碳气体,因共价键被破坏需吸收能量
D.碳酸氢铵受热分解产生氨气不仅破坏离子键还破坏了共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 单晶硅是石英的主要成分
B. 钠钾合金可用于快中子反应堆的热交换剂
C. 小苏打可用于焙制糕点
D. 水玻璃暴露在空气中会发生变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,F元素的原子最外层电子数是电子层数的二倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体、三种是固体。请回答下列问题:
(1)元素F在周期表中的位置 。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示) 。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X中所含化学键类型有 。(填数字编号)
①离子键 ②极性键 ③非极性键 ④配位键 ⑤氢键
(4)由A、B两种元素以原子个数比2:1形成的液态化合物Y含有18个电子,其水合物是一种二元弱碱,则Y的电子式为 ;由A、C、F三种元素形成的某化合物能与化合物Y形成一种酸式盐,常温下。1mol/L该酸式盐的pH为1,请写出该酸式盐的化学式 。
(5)化合物Y和A、C形成的18电子分子可相互反应生成两种产物,其中一种产物是空气的主要成分,请写出反应的化学方程式: 。
(6)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s) 设计的原电池如图所示.
请回答下列问题:
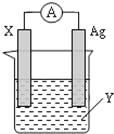
(1)X电极上电子 (填“流入”或“流出”);X电极上产生的现象是 ;电解质溶液Y是 (填化学式);
(2)银电极为电池的 正 极,发生的电极反应为 ;X电极上发生的反应类型为 ;(填“氧化反应”或“还原反应”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下单质碘为固体,单质氯为气体。尽管两者存在的状态不同,但两者( )
A. 均含离子键 B. 都含离子键和共价键
C. 均含共价键 D. 均可与H2形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等质量的甲、乙两种气体分别充入两个密闭容器中,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是
A.甲的分子数比乙的分子数多 B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小 D.甲的相对分子质量比乙的相对分子质量小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中对应关系错误的是( )
A | NaCl===Na++Cl-; NH3·H2O | 均属于电离方程式 |
B | Ba2++SO42- ===BaSO4↓; HCO3-+OH-===CO32- +H2O | 均可表示一类反应 |
C | SO2使酸性高锰酸钾溶液褪色;SO2使碱性酚酞溶液褪色 | 均利用SO2的同一性质 |
D | Cl2+2NaOH===NaCl+NaClO+H2O; 3S+6NaOH===2Na2S+Na2SO3+3H2O | Cl2和S在反应中既作氧化剂又作还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com