
【题目】依据氧化还原反应:2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s) 设计的原电池如图所示.
请回答下列问题:
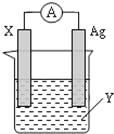
(1)X电极上电子 (填“流入”或“流出”);X电极上产生的现象是 ;电解质溶液Y是 (填化学式);
(2)银电极为电池的 正 极,发生的电极反应为 ;X电极上发生的反应类型为 ;(填“氧化反应”或“还原反应”)
【答案】(1)流出;锌逐渐溶解;AgNO3;
(2)正; Ag++e﹣=Ag; 氧化反应.
【解析】
试题分析:根据反应“2Ag+(aq)+Zn(s)=Zn2+(aq)+2Ag(s)”分析,在反应中,Zn被氧化,失电子,应为原电池的负极,电极反应为Zn﹣2e﹣=Zn2+,则正极为活泼性较Zn弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e﹣=Ag,电解质溶液为AgNO3,结合电极方程式解答该题.
解:(1)由反应“2Ag+(aq)+Zn(s)=Zn2+(aq)+2Ag(s)”可知,在反应中,Zn被氧化,失电子,锌逐渐溶解,应为原电池的负极,电子从负极流出,Ag+在正极上得电子被还原,电解质溶液为AgNO3,
故答案为:流出;锌逐渐溶解;AgNO3;
(2)正极为活泼性较Zn弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e﹣=Ag,X为负极,发生氧化反应,反应式为:Zn﹣2e﹣=Zn2+;
故答案为:正; Ag++e﹣=Ag; 氧化反应.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 标况下,将5.6g铁片投入足量浓硝酸中生成6.72L NO2气体
B. lmol FeBr2与1.2mol Cl2反应转移的电子数为2. 4mol
C. 1. 0L 1.0mol·L-1的草酸溶液中含有的H+数为2NA
D. 23g乙醇中存在的共价键总数为7NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质X的结构简式如图所示,它常被用于制香料或作为饮料的酸化剂,在医学上也有广泛用途.下列关于物质X的说法正确的是( )
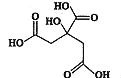
A.X的分子式为C6H7O7
B.1 mol物质x最多可以和3 mol氢气发生加成反应
C.X分子内所有原子均在同一平面内
D.足量的X分别与等物质的量的NaHCO3、Na2CO3反应得到的气体的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)分子中含有14个氢原子的烷烃的名称是 .
(2)正丁烷,异丁烷,正戊烷三种物质,按沸点由高到低顺序排列为 (用结构简式表示).
(3)相对分子质量为72的烷烃分子式为 ,它的同分异构体的结构简式为 .
(4)某烃完全燃烧生成的二氧化碳与水的物质的量比为2:3,则该烃的结构式为 .
(5)在丙烷、乙烯、苯、丁烯四种物质中,不能使酸性高锰酸钾溶液褪色的物质结构简式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗曾做过这样一个实验:一抽空的密闭容器重M g,在标准状况下,盛满以相同物质的量混合的NO和H2的混合气体后,称量为(M+Q)g.把混合气体排尽,再充满SO2气体,为使天平平衡,应在托盘天平的 边托盘上放置 g砝码.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于甲、乙、丙、丁、戊五种溶液有如下信息:①分别由NH4+、Na+、Al3+、Ba2+、Ag+和NO3-、Cl-、SO42-、Br-、CO32-离子中的各一种组成(不重复)②其中甲丙戊三种溶液呈酸性,乙溶液呈碱性③甲、乙反应生成白色沉淀和气体,丁可分别与甲乙丙反应生成白色沉淀。请回答下列问题:
(1)用化学式表示乙、丁两种物质:乙 丁
(2)用离子方程式表示戊溶液呈酸性的原因 。
(3)检验甲中阴离子的操作方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
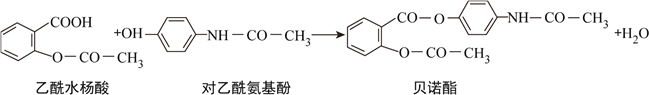
下列有关叙述正确的是( )
A. 贝诺酯分子中有三种含氧官能团
B. 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚
C. 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应
D. 贝诺酯与足量NaOH溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(6分)
(1)有机化学中取代反应范畴很广。下列6个反应中,属于取代反应范畴的是(填写相应的字母)
A.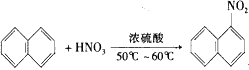 +H2O
+H2O
B.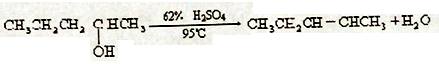
C.2CH3CH2OH ![]() CH3CH2OCH2CH3 + H2O
CH3CH2OCH2CH3 + H2O
D.(CH3)2CHCH=CH2 + 2HI![]()
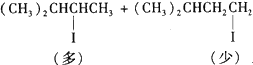
E.CH3COOH+CH3OH![]() CH3COOCH3+H2O
CH3COOCH3+H2O
F.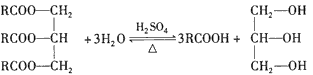 [式中R为正十七烷基CH3(CH2)15CH2-]
[式中R为正十七烷基CH3(CH2)15CH2-]
(2)Nomex纤维是一种新型阻燃性纤维。它可由间苯二甲酸和间苯二胺在一定条件下以等物质的量缩聚合成.请把Nomex纤维结构简式写在下面的方框中
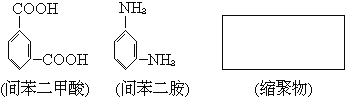
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3 (s) + 3H2 (g)![]() W (s) + 3H2O (g)。请回答下列问题:
W (s) + 3H2O (g)。请回答下列问题:
(1)上述反应的化学平衡常数表达式为____________________。
(2) 某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为___________;随温度的升高,H2与水蒸气的体积比减小,则该反应为 反应(填“吸热”或“放热”)。
(3)用H2还原WO2也可得到金属钨。已知:
WO2 (s) + 2H2 (g)![]() W (s) + 2H2O (g) ΔH = +66.0 kJ·mol–1
W (s) + 2H2O (g) ΔH = +66.0 kJ·mol–1
WO2 (g) + 2H2 (g)![]() W (s) + 2H2O (g) ΔH =-137.9 kJ·mol–1
W (s) + 2H2O (g) ΔH =-137.9 kJ·mol–1
则WO2 (s)![]() WO2 (g) 的ΔH = ______________________。
WO2 (g) 的ΔH = ______________________。
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g)![]() WI4 (g)。下列说法正确的有________(填序号)。
WI4 (g)。下列说法正确的有________(填序号)。
a.灯管内的I2可循环使用 b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com