
【题目】金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3 (s) + 3H2 (g)![]() W (s) + 3H2O (g)。请回答下列问题:
W (s) + 3H2O (g)。请回答下列问题:
(1)上述反应的化学平衡常数表达式为____________________。
(2) 某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为___________;随温度的升高,H2与水蒸气的体积比减小,则该反应为 反应(填“吸热”或“放热”)。
(3)用H2还原WO2也可得到金属钨。已知:
WO2 (s) + 2H2 (g)![]() W (s) + 2H2O (g) ΔH = +66.0 kJ·mol–1
W (s) + 2H2O (g) ΔH = +66.0 kJ·mol–1
WO2 (g) + 2H2 (g)![]() W (s) + 2H2O (g) ΔH =-137.9 kJ·mol–1
W (s) + 2H2O (g) ΔH =-137.9 kJ·mol–1
则WO2 (s)![]() WO2 (g) 的ΔH = ______________________。
WO2 (g) 的ΔH = ______________________。
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g)![]() WI4 (g)。下列说法正确的有________(填序号)。
WI4 (g)。下列说法正确的有________(填序号)。
a.灯管内的I2可循环使用 b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
【答案】(10分)(1)K= c3(H2O)/c3(H2)(2)60% 吸热
(3)+203.9 kJ/mol(4)a、b
【解析】
试题分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的化学方程式可知,该反应的平衡常数表达式K= c3(H2O)/c3(H2)。
(2)根据化学方程式WO3 (s) + 3H2 (g)![]() W (s) + 3H2O (g),氢气和水蒸气的系数相同,所以若某温度下反应达平衡时,H2与水蒸气的体积比为2:3,反应的氢气的体积为3,根据相同条件下,体积和物质的量成正比,则H2的平衡转化率为3mol÷5mol×100%=60%;反应达平衡时,随温度的升高, H2与水蒸气的体积比减小,这说明升高温度平衡正反应方向移动,所以正反应是吸热反应。
W (s) + 3H2O (g),氢气和水蒸气的系数相同,所以若某温度下反应达平衡时,H2与水蒸气的体积比为2:3,反应的氢气的体积为3,根据相同条件下,体积和物质的量成正比,则H2的平衡转化率为3mol÷5mol×100%=60%;反应达平衡时,随温度的升高, H2与水蒸气的体积比减小,这说明升高温度平衡正反应方向移动,所以正反应是吸热反应。
(3)根据盖斯定律可知,①-②即得到WO2(s)![]() WO2(g),所以ΔH=+66kJ/mol+137.9kJ/mol=+203.9kJ/mol。
WO2(g),所以ΔH=+66kJ/mol+137.9kJ/mol=+203.9kJ/mol。
(4)该反应在不同温度下,反应进行的方向是不同的。高温下生成单质碘,而温度降低后,又消耗碘,所以灯管内的I2可循环使用,a项正确;该方程式可知,WI4在灯丝上分解,产生的W是固体,会沉积在灯丝上,b正确,c错误;升高温度,反应速率都是增大,d错误,答案选ab。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s) 设计的原电池如图所示.
请回答下列问题:
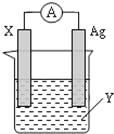
(1)X电极上电子 (填“流入”或“流出”);X电极上产生的现象是 ;电解质溶液Y是 (填化学式);
(2)银电极为电池的 正 极,发生的电极反应为 ;X电极上发生的反应类型为 ;(填“氧化反应”或“还原反应”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如下图所示,其中 T 所处的周期序数与族序数相等。下列判断不正确的是
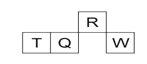
A. 最简单气态氢化物的热稳定性:R > Q
B. 含 T 的盐溶液一定显酸性
C. 原子半径:T > Q > R
D. 最高价氧化物对应水化物的酸性:Q < W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
A. 催化剂V2O5不改变该反应的逆反应速率
B. 增大反应体系的压强,反应速率一定增大
C. 该反应是放热反应,降低温度将缩短反应达到平衡的时间
D. 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关。下列有关说法错误的是
A. 利用农作物秸秆制取乙醇 B. 回收地沟油,制备生物柴油
C. 焚烧废旧塑料,防止白色污染 D. 开发利用各种新能源,减少对化石燃料的依赖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中对应关系错误的是( )
A | NaCl===Na++Cl-; NH3·H2O | 均属于电离方程式 |
B | Ba2++SO42- ===BaSO4↓; HCO3-+OH-===CO32- +H2O | 均可表示一类反应 |
C | SO2使酸性高锰酸钾溶液褪色;SO2使碱性酚酞溶液褪色 | 均利用SO2的同一性质 |
D | Cl2+2NaOH===NaCl+NaClO+H2O; 3S+6NaOH===2Na2S+Na2SO3+3H2O | Cl2和S在反应中既作氧化剂又作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
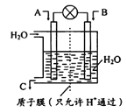
【题目】NO2、CO、CO2是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)如图所示,利用电化学原理将NO2 转化为重要化工原料C。
若A为NO2,B为O2,则负极的电极反应式为___________;
(2)光气 (COCl2)是一种重要的化工原料,用于农药、医药、
聚酯类材料的生产,工业上通过
Cl2(g)+CO(g) ![]() COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
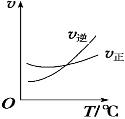
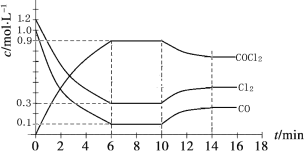
0~6 min内,反应的平均速率v(Cl2)= ;
保持温度不变,在第7min 向体系中加入这三种物质各2mol,则平衡向____________ 方向移动(填“正反应”、“逆反应”或“不”);
将初始投料浓度变为c(Cl2)=0.7mol/L、c(CO)=0.5mol/L、c(COCl2)=______ mol/L,
保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6min时Cl2的体积分数相同;
温度升高,该反应平衡常数变化的趋势是______;(填“增大”、“减小”或“不变”)
比较第8min反应温度T(8)与第15min反应温度T(15)的高低:T(8)_____T(15)
(填“<”、“>”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子在指定的分散系中能大量共存的一组是( )
A.空气:HCl、CO2、SO2、NO
B.烧碱溶液:K+、HCO![]() 、NO
、NO![]() 、NH3·H2O
、NH3·H2O
C.高锰酸钾溶液:H+、Na+、SO![]() 、CH3COOH
、CH3COOH
D.氢氧化铁胶体:H+、K+、S2-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是一种重要的有机化工原料,它可以用玉米、
薯类等为原料经发酵、蒸馏制成。乙醇和汽油经加工处理形成的车用燃料即乙醇汽油。结合有关知识,回答下列问题:
(1)写出乙醇与金属钠反应的化学方程式 ;
(2)在试管里加入2mL乙醇。把一端弯成螺旋状的铜丝放在酒精灯外焰中加热,使铜丝表面生成一薄层黑色的氧化铜,立即把它插入盛有乙醇的试管玻璃管里(如右图),取出铜丝,可以观察到铜丝表面 ,整个实验实质是乙醇与氧气反应,化学方程式为 ,检验该反应生成物的试剂是 ;

(3)下列的说法中,正确的是 (填字母序号)。
A.乙醇汽油是一种纯净物,属于可再生能源
B.使用乙醇汽油,可以节省石油资源,减少尾气的排放,保护环境
C.乙醇与乙酸反应生成的乙酸乙酯是一种无色透明、密度比水小的油状液体
D.若用 CH3CH218OH和 CH3COOH发生酯化反应,则乙酸乙酯中不含18O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com