
【题目】阿伏加德罗曾做过这样一个实验:一抽空的密闭容器重M g,在标准状况下,盛满以相同物质的量混合的NO和H2的混合气体后,称量为(M+Q)g.把混合气体排尽,再充满SO2气体,为使天平平衡,应在托盘天平的 边托盘上放置 g砝码.
【答案】右;M+4Q
【解析】
试题分析:同一容器在同一条件下盛放不同的气体时,所含分子数必然相等,NO和H2按相同物质的量混合时,气体的平均相对分子质量为![]() =16,而SO2的相对分子质量为64,则相同体积SO2的与NO和H2的混合气体的质量为4:1,据此解答.
=16,而SO2的相对分子质量为64,则相同体积SO2的与NO和H2的混合气体的质量为4:1,据此解答.
解:同一容器在同一条件下盛放不同的气体时,所含分子数必然相等,NO和H2按相同物质的量混合时,气体的平均相对分子质量为![]() =16,而SO2的相对分子质量为64,称量物品质量时,砝码应放在天平的右盘,设密闭容器内气体的物质的量为n,则盛满以相同物质的量混合的NO和H2的混合气体后,气体的质量为16n=Q,n=
=16,而SO2的相对分子质量为64,称量物品质量时,砝码应放在天平的右盘,设密闭容器内气体的物质的量为n,则盛满以相同物质的量混合的NO和H2的混合气体后,气体的质量为16n=Q,n=![]() ,当充满SO2气体时,气体的质量为:m=64n=64×
,当充满SO2气体时,气体的质量为:m=64n=64×![]() =4Q,容器的总质量为M+4Q,
=4Q,容器的总质量为M+4Q,
故答案为:右;M+4Q.


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验,下列有关说法正确的是( )
![]()
A.步骤I中减少的3g固体一定是混合物
B.步骤II中质量减少的物质一定是Cu
C.根据步骤I、II可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2
D.根据上述步骤II可以得出m(Fe2O3):m(Cu)=1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.非金属元素的原子间不能形成离子化合物
B.所有金属与所有非金属之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.含有离子键的化合物一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正确掌握好化学用语是学好化学的基础,下列有关表述正确的是( )
A.硫的原子结构示意图: 
B.NH4Br的电子式:
C.中子数为20的氩原子:![]() Ar
Ar
D.Be2+中的质子数和电子数之比为:2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s) 设计的原电池如图所示.
请回答下列问题:
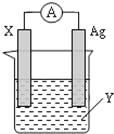
(1)X电极上电子 (填“流入”或“流出”);X电极上产生的现象是 ;电解质溶液Y是 (填化学式);
(2)银电极为电池的 正 极,发生的电极反应为 ;X电极上发生的反应类型为 ;(填“氧化反应”或“还原反应”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知a是一种常见单质,可发生如图所示的转化关系,则下列叙述中不正确的是
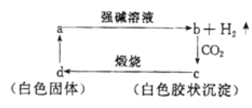
A.a在与强碱溶液的反应中氧化剂是强碱
B.向b中滴加适量盐酸可得到c
C.c不一定是两性物质
D.d一定能和氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)下图所示的装置是仿照工业制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫。
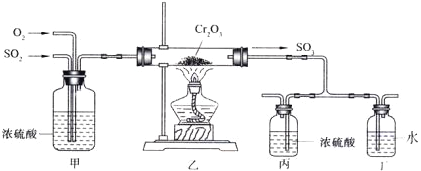
试填写下列空白:
(1)写出工业上用FeS2制取SO2的化学方程式 。
(2)写出上图中部分装置的作用:①甲_________________;
②丙和丁: 。
(3)若丁装置在反应过程中出现气泡,不久就出现了白雾,而丙装置一直没有明显变化,产生这种现象的可能原因是:①丙中插入浓硫酸溶液的导管插得太深,使两个吸收瓶内的压强差较大,导致SO3从丁的水中冒了出来,与水形成酸雾;② 。
(4)上图装置中的甲和乙部分、丙和丁部分分别与工业制取硫酸的装置相对应,甲和乙相当于 ;丙和丁相当于 。
(5)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都正确的是 (填下列各项的序号)。
A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能在空气中燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关。下列有关说法错误的是
A. 利用农作物秸秆制取乙醇 B. 回收地沟油,制备生物柴油
C. 焚烧废旧塑料,防止白色污染 D. 开发利用各种新能源,减少对化石燃料的依赖
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com