
【题目】(14分)下图所示的装置是仿照工业制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫。
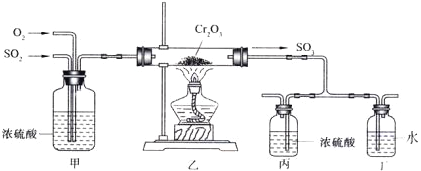
试填写下列空白:
(1)写出工业上用FeS2制取SO2的化学方程式 。
(2)写出上图中部分装置的作用:①甲_________________;
②丙和丁: 。
(3)若丁装置在反应过程中出现气泡,不久就出现了白雾,而丙装置一直没有明显变化,产生这种现象的可能原因是:①丙中插入浓硫酸溶液的导管插得太深,使两个吸收瓶内的压强差较大,导致SO3从丁的水中冒了出来,与水形成酸雾;② 。
(4)上图装置中的甲和乙部分、丙和丁部分分别与工业制取硫酸的装置相对应,甲和乙相当于 ;丙和丁相当于 。
(5)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都正确的是 (填下列各项的序号)。
A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能在空气中燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
【答案】(1)4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)①干燥SO2和O2 ②吸收SO3并做对照实验
(3)②浓硫酸对SO3的吸收效果远好于水的吸收效果,SO3被浓硫酸充分吸收
(4)接触室 吸收塔 (5)D
【解析】
试题分析:(1)黄铁矿的主要成分为FeS2,被氧气氧化为Fe2O3和SO2,反应的方程式为4FeS2+11O2![]() 2Fe2O3+8SO2。
2Fe2O3+8SO2。
(2)甲中浓硫酸的作用是干燥SO2和氧气;用浓H2SO4吸收SO3,无酸雾 ;用水吸收SO3会产生酸雾,因此丙和丁装置的作用是吸收SO3并做对照实验。
(3)根据题意可知另一个原因可能是浓硫酸对SO3的吸收效果远好于水的吸收效果,SO3被浓硫酸充分吸收。
(4)黄铁矿的煅烧在接触室内进行,SO3的吸收在吸收塔内进行,因此甲和乙相当于接触室;丙和丁相当于吸收塔;
(5)A、将硫铁矿粉碎可以增大反应物的接触面积,使燃烧速率更快,反应更充分,A错误;B、净化SO2的主要目的是防止杂质使催化剂中毒,B错误;C、催化剂只能提高反应速率,不能提高SO2的转化率,C错误;D、SO3用98%的浓H2SO4吸收,目的是防止形成酸雾,以便使SO3吸收完全,D正确,答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】a、b、c三种物质的溶解度曲线如下图所示。取等质量t2℃的a、b、c三种物质的饱和溶液,分别蒸发等量水后恢复至t2℃。下列说法不正确的是( )

A.原饱和溶液中,溶质的质量分数a>b=c
B.恢复至t2℃时,析出溶质的质量a > b=c
C.恢复至t2℃时,三种溶液一定都是饱和溶液
D.若继续降温至t1℃,三种溶液一定都是饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗曾做过这样一个实验:一抽空的密闭容器重M g,在标准状况下,盛满以相同物质的量混合的NO和H2的混合气体后,称量为(M+Q)g.把混合气体排尽,再充满SO2气体,为使天平平衡,应在托盘天平的 边托盘上放置 g砝码.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
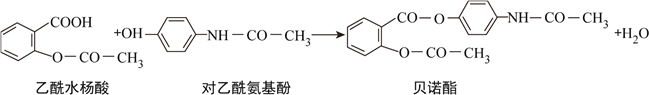
下列有关叙述正确的是( )
A. 贝诺酯分子中有三种含氧官能团
B. 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚
C. 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应
D. 贝诺酯与足量NaOH溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在空气中久置变质,在变质过程中,既有氧化还原反应发生,又有非氧化还原反应发生的是( )
A. 食盐 B. 漂白粉 C. 氯水 D. 生石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(6分)
(1)有机化学中取代反应范畴很广。下列6个反应中,属于取代反应范畴的是(填写相应的字母)
A.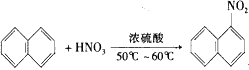 +H2O
+H2O
B.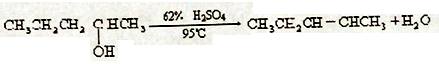
C.2CH3CH2OH ![]() CH3CH2OCH2CH3 + H2O
CH3CH2OCH2CH3 + H2O
D.(CH3)2CHCH=CH2 + 2HI![]()
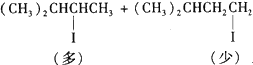
E.CH3COOH+CH3OH![]() CH3COOCH3+H2O
CH3COOCH3+H2O
F.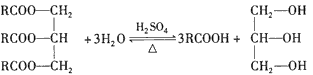 [式中R为正十七烷基CH3(CH2)15CH2-]
[式中R为正十七烷基CH3(CH2)15CH2-]
(2)Nomex纤维是一种新型阻燃性纤维。它可由间苯二甲酸和间苯二胺在一定条件下以等物质的量缩聚合成.请把Nomex纤维结构简式写在下面的方框中
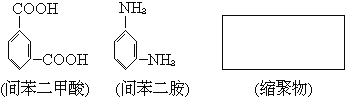
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷单质及其化合物有广泛应用。
(1)三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,三聚磷酸钠(俗称“磷酸五钠”)是常用的水处理剂,其化学式为___________________。
(2)次磷酸钠(NaH2PO2)可用于化学镀镍。
①NaH2PO2中P元素的化合价为____________。
②化学镀镍的溶液中含有Ni2+和H2PO![]() ,在酸性条件下发生下述反应,请配平:
,在酸性条件下发生下述反应,请配平:
Ni2++_______H2PO![]() +_______
+_______![]() =_______Ni++_______H2PO
=_______Ni++_______H2PO![]() +_______
+_______![]()
(3)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为
2Ca3(PO4)2+6SiO2![]() 6CaSiO3+P4O10
6CaSiO3+P4O10
10C+P4O10![]() P4+10CO
P4+10CO
若反应生成31 g P4,则反应过程中转移的电子数为____________(用NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.沸水中滴入FeCl3饱和溶液:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.一小块钠投入水中:Na+2H2O===Na++2OH-+H2↑
C.用氢氧化钠溶液吸收过量二氧化碳:OH-+CO2===HCO![]()
D.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-===2Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个氧化还原反应体系中反应物、生成物共六种粒子,Fe3+、NO![]() 、Fe2+、NH
、Fe2+、NH![]() 、H+和H2O,下列叙述正确的是( )
、H+和H2O,下列叙述正确的是( )
A.该反应说明Fe(NO3)2溶液不宜加酸酸化
B.该反应中氧化剂与还原剂物质的量之比为8∶1
C.若有1 mol NO![]() 发生氧化反应,则转移电子5 mol
发生氧化反应,则转移电子5 mol
D.若将该反应设计成原电池,则负极反应为Fe3++e-===Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com