
【题目】反应 A + 3B![]() 2C + 2D 在四种不同条件下的反应速率为:(1)v(A)=0.3mol/(L·s) (2)v(B)=0.6mol/(L·s) (3)v(C)=0.4mol/(L·s) (4)v(D)=0.45mol/(L·s),则该反应速率的快慢顺序为( )
2C + 2D 在四种不同条件下的反应速率为:(1)v(A)=0.3mol/(L·s) (2)v(B)=0.6mol/(L·s) (3)v(C)=0.4mol/(L·s) (4)v(D)=0.45mol/(L·s),则该反应速率的快慢顺序为( )
A. (2)>(4)>(3)>(1) B. (2)>(3)=(4)>(1)
C. (1)>(4)>(2)=(3) D. (4)>(3)>(2)>(1)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】MnCO3可用于制备活性电极材料MnO2。以菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料制备碳酸锰粗产品的流程如下:

已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp[Al(OH)3]=4.0×10-34。
②氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
(1)“酸浸”过程中不能用浓盐酸替代硫酸,原因是_________________________________。
(2)用离子方程式表示“氧化”过程中加MnO2的目的:_______________________________。
(3)“调pH”时,向含有硫酸铁和硫酸铝的混合溶液中滴加氢氧化钠溶液至两种沉淀共存,当c(Fe3+)=1.0×10-5mol·L-1时,c(Al3+)=______________mol·L-1。
(4)①“沉锰”过程中,反应的离子方程式为_____________________。
②“沉锰”过程中沉锰速率与温度的关系如图所示。当温度高于60℃时,沉锰速率随着温度升高而减慢的原因可能是_____________________________。

(5)从滤液3中可分离出一种不含碳元素的氮肥,它的化学式为_____________________________。
(6)工业上,可以将碳酸锰制成硫酸锰,再用惰性电极电解酸性硫酸锰溶液来制备活性二氧化锰,电解时的阳极反应式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验流程探究海带中碘的制取。甲、乙两种实验方案如下:
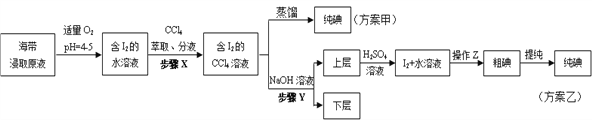
已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
(1)分液漏斗使用前须检漏,检漏方法为_____________
(2)步骤X中,萃取后分液漏斗内观察到的现象是_____________
(3)下列有关步骤Y的说法,正确的是_____________
A.应控制NaOH溶液的浓度和体积 B.将碘转化成离子进入水层
C.操作Z的名称是过滤 D.NaOH溶液可以由乙醇代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),5min后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是 0.15 mol/(Lmin)。
xC(g)+2D(g),5min后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是 0.15 mol/(Lmin)。
(1)B的反应速率v(B)=__________________X=____________
(2)A在5min末的浓度是________________
(3)此时容器内的压强与开始时之比为:___________。
(4)二氯化硫(S2Cl2)是一种琥珀色液体,是合成硫化染料的重要原料。
a. 写出它的电子式______________;
b. 指出它分子内的键型______________。
c. 指出硫元素的化合价为______________。
(5)硒的原子序数为34,硒的单质及其化合物用途非常广泛。
a.硒在元素周期表中的位置是___________。Se2Cl2常用作分析试剂,其结构式为_______。
b.硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是________(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
c.推测SeO2的化学性质(任写一条即可)_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
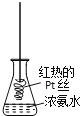
【题目】探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是( )
A. 将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B. 将pH=11的氨水稀释1000倍,测得pH>8,说明NH3·H2O为弱碱
C. 加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3受热不稳定
D. 将红热的Pt丝伸入右图所示的锥形瓶中,瓶口出现少量红棕色气体,说明氨气的氧化产物为NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油炸虾条、薯片等挤压易碎的食品不宜采用真空包装,一般在包装袋中充入某种气体防止食品被直接挤压,你认为下列气体中,最宜充入包装袋的是
A.氮气B.氧气C.氯气D.氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示为元素周期表的一部分,参照元素①~⑨在表中的位置,请回答下列问题:
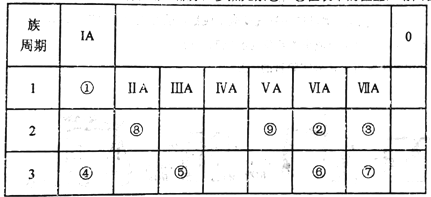
(1)③、④、⑦的原子半径由大到小的顺序是___________(用元素符号表示)。
(2)下列事实能说明②元素的非金属性比⑥元素的非金属性强的是_______。
A.②的单质与⑥元素的简单氢化物溶液反应,溶液变浑浊
B.在氧化还原反应中,1mol②单质比lmo1⑥单质得电子多
C.②和⑥两元素的简单氢化物受热分解,前者的分解温度高。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式____________________。
(4)已知周期表中存在对角相似规则,如铍(Be)与铝化学性质相似,⑧的氧化物、氢氧化物也有两性,写出⑧的氢氧化物与④的最高价氧化物的水化物反应的化学方程式_____________。
(5)已知W+X=Y+Z (反应需要加热,),W、X、Y、Z分别是由①②⑨三种元素形成的四种10电子粒子(W、X为离子,Y、Z为分子),写出该化学方程式______________。
(6)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
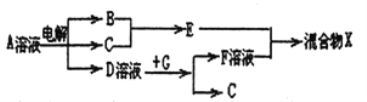
①写出D溶液与G反应的离子方程式_______________。
②写出检验A溶液中溶质的阴离子的方法_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向59.2g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0mol/L的NaOH溶液2.8L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6g。下列有关说法错误的是 ( )
A. Fe2O3和FeO的物质的量之比为1:6
B. 硝酸的物质的量浓度为3.0mol/L
C. 产生的NO在标准状况下的体积为4.48L
D. Fe2O3和FeO与硝酸反应后剩余0.2molHNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com