
 (1)铅蓄电池是典型的二次电池,由于铅蓄电池的性能优良、价格低廉、安全可靠,可多次充放电,所以在生产生活中使用广泛,总反应式是pb+pbo2+4H++2SO42-
(1)铅蓄电池是典型的二次电池,由于铅蓄电池的性能优良、价格低廉、安全可靠,可多次充放电,所以在生产生活中使用广泛,总反应式是pb+pbo2+4H++2SO42-| 放电 |
| 充电 |
| 电池 | 电解池 | |
| A | H+移向pb电极 | H+移向pb电极 |
| B | 每消耗3mol pb | 生成2molAl2O3 |
| C | 正极:pbO2+4H++2e-=pb2++2H2O | 阳极:2AL+3H2O-6e-═AL2O3+6H+ |
| D |  | 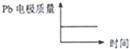 |


科目:高中化学 来源: 题型:
| A、1,3-戊二烯与溴发生加成反应的产物有3种 |
| B、乙烯和苯都能使溴水褪色,褪色的原因相同 |
| C、由于甲基对苯环的影响,使甲苯能使酸性高锰酸钾溶液褪色 |
| D、乙醇溶液呈中性,而苯酚溶液呈弱酸性,原因是苯环影响羟基,使羟基上的氢原子变得活泼了 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ |
| B、Cu溶于稀硝酸HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O |
| C、(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ |
| D、向NaAlO2溶液中通入过量CO2:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BF3是三角锥形分子 | ||
B、NH
 ,离子呈平面形结构 ,离子呈平面形结构 | ||
| C、CH4分子中的4个C-H键都是氢原子的1s轨道与碳原子的p轨道形成的s-p σ键 | ||
| D、CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个s-sp3σ键 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| X |
| X |
| H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 高温 |

| ||
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com