
【题目】已知:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,某同学探究硫代硫酸钠与酸反应速率的影响因素,设计了一系列如下实验:
实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(molL-1) | V/mL | c/(molL-1) | V/mL | ||
A | 10 | 5 | 0.1 | 5 | 0.1 | 5 |
B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
C | 30 | 5 | 0.1 | 5 | 0.1 | 5 |
D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
(1)实验过程中为什么不用测量一定时间内放出SO2气体的量来表示该反应的化学反应速率大小________________________。
(2)若要探究温度对反应速率的影响,可以选择实验中的哪些组合来比较_______(填组号)。
(3)利用反应:I2+2Na2S2O3=Na2S4O6+2NaI可定量测定市售硫代硫酸钠的纯度,现称硫代硫酸钠固体样品配成溶液,取一定量溶液置于锥形瓶中,加入指示剂,用碘水滴定。回答下列各题:
①实验中滴定管应选择_________(填酸式或碱式)滴定管,滴定前可以选择_____作为指示剂,滴定终点时的现象为_________________。
②下列操作测得硫代硫酸钠的含量偏大的是(__________)
A.滴定前滴定管内有气泡,滴定后气泡消失
B.读取碘水体积刻度时,滴定前平视,滴定后俯视
C.滴定过程中,锥形瓶震荡过于剧烈,有少量溶液溅出
D.滴定管用蒸馏水洗净后,直接加入碘水溶液
【答案】SO2在溶液中溶解,使测定SO2的量不准确 AC 酸式 淀粉 当滴加最后移动碘水时,溶液由无色变为蓝色,半分钟内不褪色 AD
【解析】
(1)由于二氧化硫在溶液中溶解,测定二氧化硫的量不准确;
(2)若要探究温度对反应速率的影响,需要使各组分相同;
(3)①碘氧化腐蚀橡胶;淀粉遇碘变蓝;
②根据c=![]() 判断产生误差的原因。
判断产生误差的原因。
(1)由于二氧化硫在溶液中溶解度较大,部分二氧化硫溶解,导致测定二氧化硫的量不准确;
(2)若要探究温度对反应速率的影响,需要Na2S2O3溶液、稀H2SO4浓度相同,只有温度不相同,A、C的浓度相同,温度不同,故合理选项是AC;
(3)①碘水具有强的氧化性,会氧化腐蚀橡胶,因此需要选取酸式滴定管;滴定完成后,碘会有剩余,可利用碘单质遇淀粉溶液变为蓝色的性质,用淀粉溶液来检验碘单质,滴定达到终点时,溶液会由无色变为蓝色,半分钟内不褪色;
②根据I2+2Na2S2O3=Na2S4O6+2NaI 知n(Na2S2O3)=2n(I2),再由c=![]() 。
。
A.滴定前滴定管内有气泡,滴定后气泡消失,使得滴定的碘水体积变大,硫代硫酸钠的含量偏大,A符合题意;
B.读取碘水体积刻度时,滴定前平视,滴定后俯视,使得碘水体积偏小,硫代硫酸钠的含量偏小,B不符合题意;
C.滴定过程中,锥形瓶震荡过于剧烈,有少量溶液溅出,使得碘水体积偏小,硫代硫酸钠的含量偏小,C不符合题意;
D.滴定管用蒸馏水洗净后,直接加入碘水溶液,使得滴定的碘水浓度偏小,为准确滴定,消耗的碘水的体积变大,则硫代硫酸钠的含量偏大,D符合题意;
故合理选项是AD。


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:
【题目】醋酸、盐酸和碳酸钠是生活中常见的物质。
(1)碳酸钠水溶液显碱性的原因是(用离子方程式表示)______。
(2)25℃时,体积相同,浓度均为0.1mol·L-1的盐酸和醋酸溶液,下列说法正确是_____。
a.两溶液的pH相同
b.两溶液中由水电离出的c(OH-)相同
c.两溶液分别与足量的金属Mg反应,产生的H2体积相同
d.两溶液中分别加入NaOH至中性,消耗NaOH物质的量相同
(3)25℃时,pH均等于4的醋酸溶液和氯化铵溶液,醋酸溶液中水电离出的H+浓度与氯化铵溶液中水电离出的H+浓度之比是______。
(4)醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,下列叙述不正确的是___。
CH3COO-+H+,下列叙述不正确的是___。
a.CH3COOH溶液中离子浓度关系满足:c(H+)=c(OH-)+c(CH3COO)
b.0.1mol·L-1的CH3COOH 溶液加水稀释,溶液中c(OHˉ)减小
c.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动
d.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后溶液的pH>7
e.室温下pH=3的醋酸溶液加水稀释,溶液中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G均为有机物,其中A常用来衡量一个国家石油化工发展水平的标志性物质,它们之间有如下转化关系。
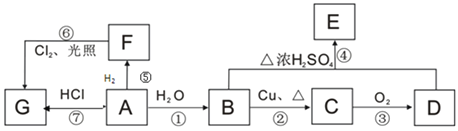
已知:![]() ,请回答下列问题:
,请回答下列问题:
(1)B、D中官能团的名称:B____________,D________________。
(2)指出下列编号对应反应的反应类型:①____________,⑥_____________。
(3)在F的同系物中最简单的有机物的空间构型为___________,电子式为____________。
(4)写出与E含有相同官能团(不含E)的所有同分异构体的结构简式:_________。
(5)写出下列编号对应反应的化学反应方程式:
②_______________________;
④______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.pH=1的溶液中: Fe2+,NO3-,SO42-,Na+
B.由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+,K+,Cl-,HCO3-
C.![]() =1012的溶液中:NH4+,Al3+,NO3-,Cl-
=1012的溶液中:NH4+,Al3+,NO3-,Cl-
D.c(Fe3+) =0.1 mol·L-1的溶液中:K+,ClO-,SO42-,SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理的有关知识回答下列问题:
(1)晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)=SiO2(s)△H=-989.2 kJ·mol-1,有关键能数据如下表:
化学键 | Si-O | O=O | Si-Si |
键能kJ·mol-1 | X | 498.8 | 176 |
则X的值为_________。
(2)加热N2O5,依次发生的分解反应为①N2O5![]() N2O3+O2,②N2O3
N2O3+O2,②N2O3![]() N2O+O2,在1 L密闭容器中充入4 mol N2O5,加热到t ℃,达到平衡状态后O2的平衡浓度为4.5 mol/L,N2O3的平衡浓度为1.7 mol/L,则t℃时反应①的平衡常数为_________。
N2O+O2,在1 L密闭容器中充入4 mol N2O5,加热到t ℃,达到平衡状态后O2的平衡浓度为4.5 mol/L,N2O3的平衡浓度为1.7 mol/L,则t℃时反应①的平衡常数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是( )
A.7.8g苯含σ键的数目为0.6NA
B.将Cl2通入FeBr2溶液中,有1molBr2生成时,转移的电子数为2NA
C.1molNH4NO3完全溶于稀氨水中,溶液呈中性,溶液中NH![]() 的数目为NA
的数目为NA
D.有铁粉参加的反应若生成3molFe2+,则转移电子数一定为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )

A. Mg 电极是该电池的正极
B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH 增大
D. 溶液中Cl-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01molL-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O![]() 的水解)。已知Ksp(AgCl)数量级为10-10。下列叙述不正确的是( )
的水解)。已知Ksp(AgCl)数量级为10-10。下列叙述不正确的是( )
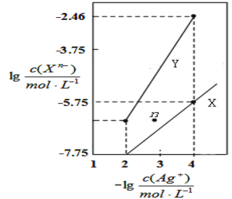
A.Ksp(Ag2C2O4)数量级为10-11
B.n点表示Ag2C2O4的过饱和溶液
C.向c(Cl-)=c(C2O![]() )的混合液中滴入AgNO3溶液时,先生成AgCl沉淀
)的混合液中滴入AgNO3溶液时,先生成AgCl沉淀
D.Ag2C2O4(s)+2Cl-(aq)![]() 2AgCl(s)+C2O
2AgCl(s)+C2O![]() (aq)的平衡常数为10-0.71
(aq)的平衡常数为10-0.71
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化如图所示,则下列说法中正确的是
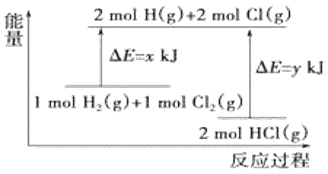
A.该反应是吸热反应
B.断裂1molH-H键和1molCl-Cl键时能放出x kJ的能量
C.断裂2molH-Cl键时需要吸收y kJ的能量
D.2molHCl(g)的总能量高于1molH2(g)和1molCl2(g)的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com