
【题目】对于可逆反应N2(g)+3H2(g)2NH3(g)△H<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
图示 |
|
|
|
|
A.A
B.B
C.C
D.D
【答案】C
【解析】A、该反应中增大压强平衡向正反应方向移动,则氨气的体积分数增大,并且压强越大,化学反应速率越大,达到化学平衡的时间越少,与图象不符,故A不符合题意;
B、因该反应是放热反应,升高温度化学平衡向逆反应反应移动,则氮气的转化率降低,与图象中转化率增大不符,故B不符合题意;
C、反应平衡后,增大氮气的量,则这一瞬间正反应速率增大,逆反应速率不变,然后正反应速率在不断减小,逆反应速率不断增大,直到新的平衡,与图象符合,故C符合题意;
D、因催化剂对化学平衡无影响,但催化剂加快化学反应速率,则有催化剂时达到化学平衡的时间少,与图象不符,故D不符合题意;
故答案为:C.
A.根据压强对反应速率和化学平衡的影响进行判断;
B.温度升高平衡向逆反应方向移动,氮气的转化率降低;
C.根据浓度对反应速率和化学平衡的影响进行判断;
D.催化剂可加快反应速率,达到平衡的时间较短.


科目:高中化学 来源: 题型:
【题目】用 A 质子数 B 中子数 C 核外电子数 D 最外层电子数 E 电子层数 填写下列空白:
(1)原子种类由_______决定;
(2)元素种类由_______决定;
(3)元素的化学性质主要由_______决定;
(4)元素的原子半径由_______决定;
(5)元素的化合价主要由_______决定。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉酶能在极短时间内催化淀粉水解,但不能使麦芽糖发生水解,这体现了酶的( )
A. 高效性和多样性 B. 催化性和专一性
C. 高效性和专一性 D. 催化性和高效性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】每年3月22日是“世界水日”,联合国确定2016年“世界水日”的宣传主题是““水与就业”。下列关于水的叙述不正确的是 ( )
A.生化反应必须在水中进行
B.水是细胞鲜重中含量最多的化合物
C.水在细胞中的存在形式并非一成不变
D.自由水与结合水的比例与新陈代谢的强弱关系不大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度时,N2与H2反应过程中能量变化的曲线如图.下列叙述正确的是( )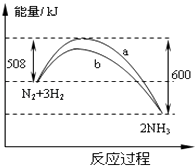
A.该反应的热化学方程式为:N2+3H22NH3△H=﹣92kJ/moL
B.b曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的放热增多
D.加入催化剂可增大正反应速率,降低逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4 , 发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
(1)反应的△H0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示.在0~60s时段,反应速率v(N2O4)为 molL﹣1s﹣1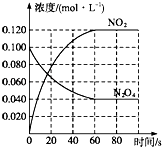
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0molL﹣1s﹣1的平均速率降低,经10s又达到平衡.T100℃(填“大于”或“小于”),判断理由是 .
(3)温度T时反应达平衡后,将反应容器的容积减少一半.平衡向(填“正反应”或“逆反应”)方向移动,判断理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置(夹持仪器已略去)探究铜与过量浓硫酸的反应。下列实验不合理的是

A. 为确认CuSO4生成,直接向①中加水,观察颜色
B. ②中选用品红溶液验证SO2的生成
C. ③中选用NaOH溶液吸收多余的SO2
D. 上下移动①中铜丝可控制SO2的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①—⑨在表中的位置,回答下列问题。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)第三周期中元素非金属性最强的元素的原子结构示意图是_____________。
(2)②③⑦最高价氧化物对应水化物酸性由强到弱的顺序是_________(填化学式)。
(3)用电子式表示⑨的氢化物的形成过程:_________________________。
(4)下列可以判断⑤和⑥金属性强弱的是________________(填序号)。
a. 单质的熔点⑤比⑥低 b. 化合价⑤比⑥低
c. 单质与水反应⑤比⑥剧烈 d. 最高价氧化物的水化物的碱性⑤比⑥强
(5)为验证ⅦA族部分元素非金属性的递变规律,设计下图装置进行实验,请回答:
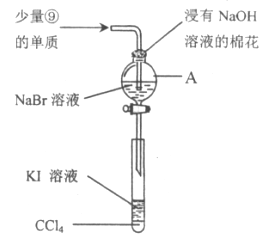
①仪器A的名称是_____________,A中发生的反应的离子方程式是_________。
②棉花中浸有的NaOH溶液的作用是(用离子方程式表示)_____________________。
③为验证溴与碘非金属性强弱:通入少量⑨的单质,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到____________________。该实验必须控制加入的⑨单质的量,否则得不出溴的非金属性比碘强。理由是_____________________。
④ⅦA族元素,非金属性随元素核电荷数增加而逐渐减弱的原因:同主族元素从上到下原子半径逐渐______________(填“增大”或“减小”),得电子能力逐渐减弱。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数,下列叙述正确的是( )
①NaHSO4晶体中阳离子和阴离子的数目比为1:1
②22.4LCH4与18gH2O所含有的电子数均为10NA
③1molSiO2晶体中含NA个SiO2分子
④标准状况下,2.24LCCl4含有的共价键数为0.4NA
⑤20gD2O和18gH2O中含有的质子数均为10NA
⑥在K35ClO3+6H37Cl===KCl+3Cl2↑+3H2O中,若生成71gCl2,则转移的电子数目为![]() NA
NA
⑦在含1mol硅原子的二氧化硅晶体中含有4NA个Si—O键
A. ①②③④⑤⑦ B. ①⑤⑥⑦ C. ①⑤⑦ D. ④⑤⑥⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com