
����Ŀ�����ݻ�Ϊ1.00L�������У�ͨ��һ������N2O4 �� ������ӦN2O4��g��2NO2��g�������¶����ߣ�����������ɫ����ش��������⣺
��1����Ӧ�ġ�H0������ڡ���С�ڡ�����100��ʱ����ϵ�и�����Ũ����ʱ��仯��ͼ��ʾ����0��60sʱ�Σ���Ӧ����v��N2O4��Ϊ molL��1s��1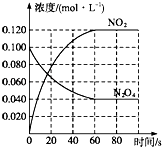
��2��100��ʱ��ƽ��ı䷴Ӧ�¶�ΪT��c��N2O4����0.002 0molL��1s��1��ƽ�����ʽ��ͣ���10s�ִﵽƽ�⣮T100�棨����ڡ���С�ڡ������ж������� ��
��3���¶�Tʱ��Ӧ��ƽ�����Ӧ�������ݻ�����һ�룮ƽ�����������Ӧ�����淴Ӧ���������ƶ����ж������� ��
���𰸡�
��1����,0.0010
��2����,�ı��¶Ⱥ�,N2O4Ũ�ȼ�С,��Ӧ�������,��������,���¶�����
��3���淴Ӧ,������������,����ѹǿ,ƽ�������������С�ķ����ƶ�
���������⣺��1�����¶ȵ����ߣ�����������ɫ�����ѧƽ��������Ӧ�����ƶ�������H��0��0��60sʱ�Σ�N2O4Ũ�ȱ仯Ϊ��0.1mol/L��0.04mol/L=0.06mol/L��v��N2O4��= ![]() =0.0010molL��1s��1��
=0.0010molL��1s��1��
�ʴ�Ϊ������0.0010molL��1s��1��
��2��N2O4��Ũ�Ƚ��ͣ�ƽ��������Ӧ�����ƶ�����������Ӧ�������ȣ�T��100�棬
�ʴ�Ϊ�������ı��¶Ⱥ�c��N2O4������ƽ�������ƶ�������ӦΪ���ȷ�Ӧ�����¶����ߣ�
��3����Ӧ�������ݻ�����һ�룬ѹǿ��������Ӧ�������������������ѹǿ�������������С�ķ����ƶ���
�ʴ�Ϊ���淴Ӧ�������������䣬����ѹǿ��ƽ�������������С�ķ����ƶ���
��1���¶����ߣ���ɫ���ƽ��������Ӧ�����ƶ����ݴ��ж��ʱ䣻���ݷ�Ӧ���ʵĶ�����㷴Ӧ���ʣ�
��2�������¶ȶԻ�ѧƽ���Ӱ������жϣ�
��3������ѹǿ�Ի�ѧƽ���Ӱ������ж�.



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ç��������ںϳ�ҩ���ƣ���ṹ��ʽ��ͼ�����й���ç�����˵����ȷ����
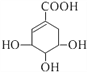
A. ç�������ʽΪC7H10O
B. ç��������к������ֹ�����
C. һ��������ç����ɷ���ȡ�����ӳɡ�������Ӧ
D. 1molç��������ܺ�4mol NaOH�����кͷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������25��ʱ0.1molL��1�İ�ˮ����ش��������⣺
��1������ˮ�м�����������粒��壬һˮ�ϰ��ĵ���ƽ���ƶ�������������ҡ�����������ʱ��Һ��C��OH����/C��NH3H2O�������������С�����䡱����
��2������ˮ�м���ϡ��������Һ��pH=7����ʱC��NH4+��=a molL��1 �� ��C��SO42����= ��
��3������ˮ�м���ϡ���ᣬʹ��ǡ���кͣ�д����Ӧ�����ӷ���ʽ����
������Һ��pH7�����������������=�����������ӷ���ʽ��ʾ��ԭ�� �� ������Һ�и����ӵ����ʵ���Ũ���ɴ�С��˳�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС�鰴�������̣����к����е⺬���IJⶨ��
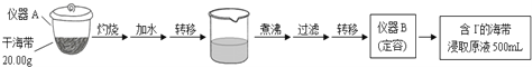
��1��д���������ƣ�A______��B______��
��2��ȡ20.00 mL����������ȡԭҺ����ϡH2SO4������KIO3��ʹI����IO3����ȫ��Ӧ�����Ե���Ϊָʾ������2.0��10��3mol/L��Na2S2O3��Һ�ζ�����I2ǡ����ȫ��Ӧʱ����ȥNa2S2O3��Һ20.00mL������֪��5I��+ IO3��+ 6H+=3I2 + 3H2O��I2 + 2S2O32��=2I��+ S4O62����
���ж���Na2S2O3��Һ�ζ�ǡ����ȫ��Ӧ��������______��
�ڼ���øɺ����е����������______����д��������̣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴ӦN2��g��+3H2��g��2NH3��g����H��0�������о�Ŀ�ĺ�ʾ��ͼ������ǣ�������
A | B | C | D | |
�о�Ŀ�� | ѹǿ�Է�Ӧ��Ӱ�죨P2��P1�� | �¶ȶԷ�Ӧ��Ӱ�� | ƽ����ϵ����N2�Է�Ӧ��Ӱ�� | �����Է�Ӧ��Ӱ�� |
ͼʾ |
|
|
|
|
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʱ��������������������������������������������ϸ���к������Ļ������뺬�������л������ﹲ�еĻ�ѧԪ���� �� ��
A��C��H��O B��C��H��O��N C��H��O D��N��P��S
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ơ���ʿ������ҩ��˾������һ�����������кͼ���H1N1���У������У�����Чҩ����Ƶ���Ҫ��Ч�ɷ�ç�����Ǵ��й����ճ����ĵ�ζ�ϰ˽���������ȡ�����ģ�ç����Ľṹʽ��ͼ������˵����ȷ���ǣ�������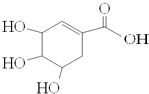
A.����ʹ��ˮ��ɫ
B.��FeCl3��Һ����ɫ
C.�����ܷ�����ȥ��Ӧ
D.1molç������������Ʒ�Ӧ���Եõ�4molH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ܱ������еĿ��淴Ӧ��mX(g)��nY(s) ![]() pZ(g) ��H��0���ﵽ��ѧƽ��ı����������б�������ȷ����( )
pZ(g) ��H��0���ﵽ��ѧƽ��ı����������б�������ȷ����( )
A.����ѹǿ����ѧƽ�ⲻһ�������ƶ�
B.ͨ�뺤������ѧƽ�ⲻһ�������ƶ�
C.����X��Y�����ʵ�������ѧƽ��һ�������ƶ�
D.�����������䣬�����¶ȣ���ѧƽ��һ�������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦmA(g)+nB(g) ![]() pC(g)��һ���¶ȺͲ�ͬѹǿ�´ﵽƽ��ʱ���ֱ�õ�A�����ʵ���Ũ�����±���ʾ��
pC(g)��һ���¶ȺͲ�ͬѹǿ�´ﵽƽ��ʱ���ֱ�õ�A�����ʵ���Ũ�����±���ʾ��
ѹǿ/Pa | 2��105 | 5��105 | 1��106 |
c(A)/(mol��L-1) | 0.08 | 0.20 | 0.44 |
�����������ݣ��ش�
��1����ѹǿ��2��105 Pa���ӵ�5��105 Paʱ��ƽ��(��������ҡ�����)�ƶ�����������
��2����ѹǿ��5��105 Pa���ӵ�1��106 Paʱ���÷�Ӧ�Ļ�ѧƽ���ƶ����жϵ������� �� ���ܵ�ԭ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com