
【题目】某化学兴趣小组按如下流程,进行海带中碘含量的测定。
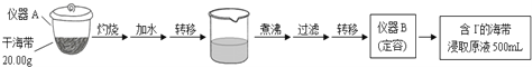
(1)写出仪器名称:A______,B______。
(2)取20.00 mL上述海带浸取原液,加稀H2SO4和足量KIO3,使I-和IO3-完全反应。再以淀粉为指示剂,用2.0×10-3mol/L的Na2S2O3溶液滴定,当I2恰好完全反应时,用去Na2S2O3溶液20.00mL。(已知:5I-+ IO3-+ 6H+=3I2 + 3H2O;I2 + 2S2O32-=2I-+ S4O62-)
①判断用Na2S2O3溶液滴定恰好完全反应的现象是______。
②计算该干海带中碘的质量分数______。(写出计算过程)
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数递增的4种短周期元素,其中Y、Z为金属元素。X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(图中“一”相连的两种物质能发生反应)。下列判断正确的是

A. X是元素周期表中非金属性最强的元素
B. Z冶炼可通过电解其氯化物的方式获得
C. 4种原子中,Y离子半径最小
D. W的阴离子可能促进水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于脂质的叙述中错误的是 ( )
A.脂肪是重要的储能物质,同质量的脂肪中含有比糖类更多的能量
B.脂质中的磷脂是构成细胞膜的主要成分之一
C.有的脂质可以由内分泌腺分泌,如性激素
D.胆固醇对生命活动具有一定的调节作用,所以它既是脂质也是激素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A.反应物的总能量低于生成物的总能量时,该反应必须加热才能发生
B.2H2(g)+O2(g)=2H2O(l);△H=﹣571.6kJmol﹣1 , 则氢气燃烧热为285.8kJmol﹣1
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=﹣57.3kJmol﹣1
D.已知2SO2(g)+O2(g)2SO3(g);△H=﹣QkJmol﹣1(Q>0),则将16gSO2(g)和足量O2置于一密闭容器中,充分反应后放出0.25QkJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】每年3月22日是“世界水日”,联合国确定2016年“世界水日”的宣传主题是““水与就业”。下列关于水的叙述不正确的是 ( )
A.生化反应必须在水中进行
B.水是细胞鲜重中含量最多的化合物
C.水在细胞中的存在形式并非一成不变
D.自由水与结合水的比例与新陈代谢的强弱关系不大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究物质的微观结构,有助于人们理解物质变化的本质。
(1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
电离能 | I1 | I2 | I3 | I4 | I5 | …… |
Im/kJ·mol-1 | 578 | 1817 | 2745 | 11575 | 14830 | …… |
则该元素是______(填元素符号)。
(2)氮元素可以形成许多化合物,在我们生活生产中有广泛的应用。
①维生素B4结构如图所示,则碳原子的轨道杂化类型是_________;1 mol维生素B4分子中含有σ键的数目为________。
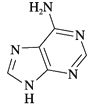
②NF3的空间构型为______(用文字描述);与NF3分子互为等电子体的阴离子为______(填化学式)。
(3)过渡元素常与H2O、NH3、CN-、SCN-等形成配合物。
①C、N、O三种元素的电负性由大到小的顺序为________。
②X、Y均为第四周期元素。X基态原子的内层轨道全部排满电子,且最外层电子数为1。Y基态原子在同周期元素中未成对电子数最多,则X+基态核外电子排布式________;元素Y在周期表中位于第________族。
③在配离子[Fe(SCN)]2+中,提供空轨道的是________;[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,则[Zn(CN)4]2-的结构可用示意图表示为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4 , 发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
(1)反应的△H0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示.在0~60s时段,反应速率v(N2O4)为 molL﹣1s﹣1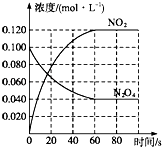
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0molL﹣1s﹣1的平均速率降低,经10s又达到平衡.T100℃(填“大于”或“小于”),判断理由是 .
(3)温度T时反应达平衡后,将反应容器的容积减少一半.平衡向(填“正反应”或“逆反应”)方向移动,判断理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应CH4+2O2![]() CO2+2H2O的说法中,正确的是
CO2+2H2O的说法中,正确的是
A. 该反应中,热能转化为化学能
B. 反应物的总能量低于生成物的总能量
C. 反应时,断键吸收的总能量高于成键放出的总能量
D. 根据此反应设计的燃料电池,可提高甲烷的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含锰矿物的主要成分有MnCO3、MnO2、FeCO3、SiO2、Al2O3等。已知FeCO3、MnCO3难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,主要物质转化关系如下:

(1)设备1中反应后,滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2。滤渣1的主要成分是 (填化学式)。
(2)设备1中发生氧化还原反应的离子方程式是 。
(3)设备2中加足量双氧水的作用是 。设计实验方案检验滤液2中是否存在Fe2+: 。
(4)设备4中加入过量氢氧化钠溶液,沉淀部分溶解,。用化学平衡移动原理解释原因: 。
(5)设备3中用阴离子膜法提取金属锰的电解装置图如下:

① 电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的 极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为 。
② 该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com