
【题目】X、Y、Z、W为原子序数递增的4种短周期元素,其中Y、Z为金属元素。X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(图中“一”相连的两种物质能发生反应)。下列判断正确的是

A. X是元素周期表中非金属性最强的元素
B. Z冶炼可通过电解其氯化物的方式获得
C. 4种原子中,Y离子半径最小
D. W的阴离子可能促进水的电离
【答案】D
【解析】Y、Z为金属元素,对应的最高价氧化物对应的水化物可发生反应,则应为氢氧化铝和氢氧化钠的反应,可知Y为Na、Z为Al,乙为NaOH,丙为Al(OH)3,X应为N,甲为HNO3,W可为为S、Cl,则丁可能为H2SO4、HClO4。由以上分析可知X为N、Y为Na、Z为Al、W为S或Cl,甲为HNO3,乙为NaOH,丙为Al(OH)3,丁为H2SO4或HClO4。A.X为N,元素周期表中非金属性最强的元素为F,故A错误;B.Z为Al,位于周期表第三周期ⅢA族,故B错误;C.4种原子中,半径最小的为N,Y为Na,原子半径最大,故C错误;D.如W为S,对应的离子为S2-,水解呈碱性,可促进水的电离,故D正确;故选D。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】表没食子儿茶素没食子酸酯(EGCG)是中国绿茶中主要的活性成份,下列说法正确的是
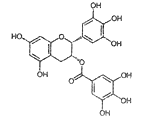
A. 分子式为C22H20O11
B. 分子只有1个手性碳原子
C. 分子易发生氧化反应,因此绿茶具有抗氧化性
D. 1mol该化合物与足量的NaOH溶液反应,最多消耗10molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼位于ⅢA族,三氯化硼(BCl3)可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
查阅资料:①BCl3的沸点为12.5℃,熔点为-107.3℃;②![]() ;③硼能与氢氧化钠溶液反应(与铝性质相似)。
;③硼能与氢氧化钠溶液反应(与铝性质相似)。
设计实验:某同学设计如图所示装置利用氯气和单质硼反应制备三氯化硼
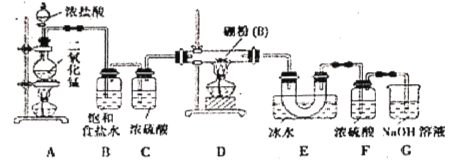
(1)常温下,高锰酸钾固体和浓盐酸反应可以代替A装置中的反应,请写出高锰酸钾固体与浓盐酸反应的离子方程式___________________________________。
(2)E装置的作用是______________________;如果拆去B装置,可能后果是___________________。
(3)实验中可以用一个盛装____________(填试剂名称)的干燥管代替F和G装置,使实验更简便。
(4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式:___________。
(5)为了顺利完成实验,正确的操作是_______(填序号)。
①先点燃A处酒精灯,后点燃D处酒精灯;②先点燃D处酒精灯,后点然A处酒精灯;③同时点燃A, D处酒精灯
(6)请你补充完整下面的简易实验,以验证制得的产品中是否含有硼粉:取少量样品于试管中,滴加浓_________(填化学式)溶液,若有气泡产生,则样品中含有硼粉;若无气泡产生,则样品中无硼粉。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活密切相关,下列叙述不正确的是
A.铁路建设所需的大量水泥属于新型无机非金属材料
B.豆科植物根瘤菌可以在常温常压下把氮气转化为氮的化合物
C.在含硫的燃料中加入适量生石灰,以减少二氧化硫的排放量
D.自来水中通入氯气用来杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若用AG表示溶液的酸度,其表达式为AG= 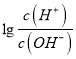 室温下,实验室里用0.1mol/L的盐酸滴定10mL0.1mol/LMOH溶液,滴定曲线如图所示。下列说法正确的是
室温下,实验室里用0.1mol/L的盐酸滴定10mL0.1mol/LMOH溶液,滴定曲线如图所示。下列说法正确的是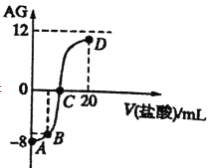
A. 该滴定过程可选择酚酞作为指示剂
B. 若B点加入的盐酸体积为5mL,所得溶液中:c(M+)+2c(H+)=c(MOH)+2c(OH-)
C. 水的电离程度:A
D. MOH的电离平衡常数为1×10-17
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到目的的是
A. 用裂化汽油萃取碘水中的碘
B. 用水鉴别苯、四氯化碳、乙醇三种无色液体
C. 用如图装置验证Na和水反应是否为放热反应
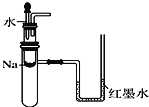
D. 往酸性KMnO4溶液中加入乙醇,验证乙醇的还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莽草酸可用于合成药物达菲,其结构简式如图。下列关于莽草酸的说法正确的是
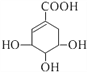
A. 莽草酸分子式为C7H10O
B. 莽草酸分子中含有两种官能团
C. 一定条件下莽草酸可发生取代、加成、氧化反应
D. 1mol莽草酸最多能和4mol NaOH发生中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:
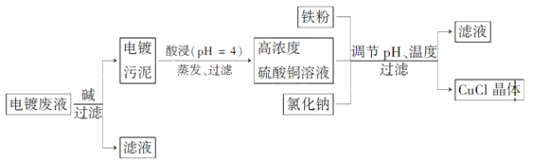
金属离子含量与混合液pH、CuCl产率与混合液pH的关系图如图。
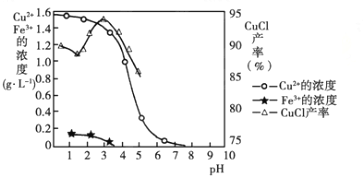
【已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7】
请回答下列问题:
(1)酸浸时发生反应的离子方程式是________;析出CuCl晶体时的最佳pH在_______左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为________________。
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2 h、冷却密封包装。70℃真空干燥、密封包装的目的是_____________。
(4)产品滤出时所得滤液的主要分成是________,若想从滤液中获取FeSO4·7H2O晶体,还需要知道的是__________________。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式:______________。为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是_____________。
(6)工业上还可以采用以碳棒为电极电解CuCl2溶液得到CuCl。写出电解CuCl2溶液中的阴极上发生的电极反应:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组按如下流程,进行海带中碘含量的测定。
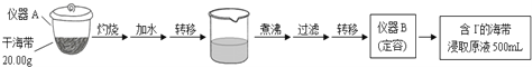
(1)写出仪器名称:A______,B______。
(2)取20.00 mL上述海带浸取原液,加稀H2SO4和足量KIO3,使I-和IO3-完全反应。再以淀粉为指示剂,用2.0×10-3mol/L的Na2S2O3溶液滴定,当I2恰好完全反应时,用去Na2S2O3溶液20.00mL。(已知:5I-+ IO3-+ 6H+=3I2 + 3H2O;I2 + 2S2O32-=2I-+ S4O62-)
①判断用Na2S2O3溶液滴定恰好完全反应的现象是______。
②计算该干海带中碘的质量分数______。(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com