
【题目】对于密闭容器中的可逆反应:mX(g)+nY(s) ![]() pZ(g) ΔH<0,达到化学平衡后,改变条件,下列表述不正确的是( )
pZ(g) ΔH<0,达到化学平衡后,改变条件,下列表述不正确的是( )
A.增大压强,化学平衡不一定发生移动
B.通入氦气,化学平衡不一定发生移动
C.增加X或Y的物质的量,化学平衡一定发生移动
D.其它条件不变,升高温度,化学平衡一定发生移动
【答案】C
【解析】A.通过改变体积增大压强,若反应前后气体的体积不变,平衡不移动,若反应前后气体的体积发生变化,平衡发生移动,A不符合题意;
B.恒温恒容下,通入氦气,平衡体系各组分的浓度不变,平衡不移动,恒温恒压下,通入氦气,容器体积增大,反应混合物各组分的浓度减小,平衡向体积增大的方向移动,B不符合题意;
C.Y为固体,增大Y的用量,平衡不移动,C符合题意;
D.正反应为放热反应,升高温度平衡向逆反应方向移动,D不符合题意。
所以答案是:C
【考点精析】本题主要考查了化学平衡状态本质及特征的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】下列关于脂质的叙述中错误的是 ( )
A.脂肪是重要的储能物质,同质量的脂肪中含有比糖类更多的能量
B.脂质中的磷脂是构成细胞膜的主要成分之一
C.有的脂质可以由内分泌腺分泌,如性激素
D.胆固醇对生命活动具有一定的调节作用,所以它既是脂质也是激素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4 , 发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
(1)反应的△H0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示.在0~60s时段,反应速率v(N2O4)为 molL﹣1s﹣1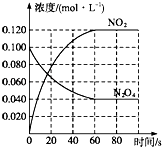
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0molL﹣1s﹣1的平均速率降低,经10s又达到平衡.T100℃(填“大于”或“小于”),判断理由是 .
(3)温度T时反应达平衡后,将反应容器的容积减少一半.平衡向(填“正反应”或“逆反应”)方向移动,判断理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应CH4+2O2![]() CO2+2H2O的说法中,正确的是
CO2+2H2O的说法中,正确的是
A. 该反应中,热能转化为化学能
B. 反应物的总能量低于生成物的总能量
C. 反应时,断键吸收的总能量高于成键放出的总能量
D. 根据此反应设计的燃料电池,可提高甲烷的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①—⑨在表中的位置,回答下列问题。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)第三周期中元素非金属性最强的元素的原子结构示意图是_____________。
(2)②③⑦最高价氧化物对应水化物酸性由强到弱的顺序是_________(填化学式)。
(3)用电子式表示⑨的氢化物的形成过程:_________________________。
(4)下列可以判断⑤和⑥金属性强弱的是________________(填序号)。
a. 单质的熔点⑤比⑥低 b. 化合价⑤比⑥低
c. 单质与水反应⑤比⑥剧烈 d. 最高价氧化物的水化物的碱性⑤比⑥强
(5)为验证ⅦA族部分元素非金属性的递变规律,设计下图装置进行实验,请回答:
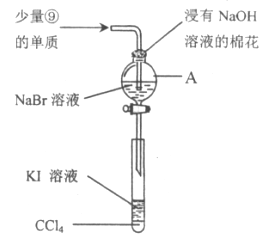
①仪器A的名称是_____________,A中发生的反应的离子方程式是_________。
②棉花中浸有的NaOH溶液的作用是(用离子方程式表示)_____________________。
③为验证溴与碘非金属性强弱:通入少量⑨的单质,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到____________________。该实验必须控制加入的⑨单质的量,否则得不出溴的非金属性比碘强。理由是_____________________。
④ⅦA族元素,非金属性随元素核电荷数增加而逐渐减弱的原因:同主族元素从上到下原子半径逐渐______________(填“增大”或“减小”),得电子能力逐渐减弱。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、社会发展息息相关,下列有关说法不正确的是( )
A. 在元素周期表的金属和非金属分界线附近寻找半导体材料
B. 漂白粉失效是由于漂白粉中的Ca(ClO)2与空气中的CO2反应生成的HClO见光分解
C. 少量液溴要保存在棕色细口瓶中,并在液溴上面加水封
D. 向煤中加入适量CaCO3,可大大减少燃烧产物中温室气体的排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含锰矿物的主要成分有MnCO3、MnO2、FeCO3、SiO2、Al2O3等。已知FeCO3、MnCO3难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,主要物质转化关系如下:

(1)设备1中反应后,滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2。滤渣1的主要成分是 (填化学式)。
(2)设备1中发生氧化还原反应的离子方程式是 。
(3)设备2中加足量双氧水的作用是 。设计实验方案检验滤液2中是否存在Fe2+: 。
(4)设备4中加入过量氢氧化钠溶液,沉淀部分溶解,。用化学平衡移动原理解释原因: 。
(5)设备3中用阴离子膜法提取金属锰的电解装置图如下:

① 电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的 极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为 。
② 该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于“塑料废弃物”的处理方法,最恰当的是( )
A.将废弃物焚烧
B.将废弃物填埋于土壤中
C.将废弃物倾倒在海洋中
D.将废弃物加工成防水材料或汽油,变废为宝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com