
【题目】下表为元素周期表的一部分,请参照元素①—⑨在表中的位置,回答下列问题。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)第三周期中元素非金属性最强的元素的原子结构示意图是_____________。
(2)②③⑦最高价氧化物对应水化物酸性由强到弱的顺序是_________(填化学式)。
(3)用电子式表示⑨的氢化物的形成过程:_________________________。
(4)下列可以判断⑤和⑥金属性强弱的是________________(填序号)。
a. 单质的熔点⑤比⑥低 b. 化合价⑤比⑥低
c. 单质与水反应⑤比⑥剧烈 d. 最高价氧化物的水化物的碱性⑤比⑥强
(5)为验证ⅦA族部分元素非金属性的递变规律,设计下图装置进行实验,请回答:
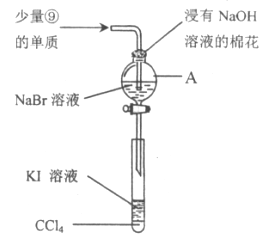
①仪器A的名称是_____________,A中发生的反应的离子方程式是_________。
②棉花中浸有的NaOH溶液的作用是(用离子方程式表示)_____________________。
③为验证溴与碘非金属性强弱:通入少量⑨的单质,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到____________________。该实验必须控制加入的⑨单质的量,否则得不出溴的非金属性比碘强。理由是_____________________。
④ⅦA族元素,非金属性随元素核电荷数增加而逐渐减弱的原因:同主族元素从上到下原子半径逐渐______________(填“增大”或“减小”),得电子能力逐渐减弱。
【答案】 ![]() HNO3>H2CO3>H2SiO3
HNO3>H2CO3>H2SiO3 ![]() cd 分液漏斗 2Br-+Cl2=Br2+2C1- Cl2+2OH-=H2O+Cl-+ClO- 溶液分层,下层液体为紫红色 氯气能够氧化溴离子和碘离子,氯气必须少量,否则干扰了检验结果 增大
cd 分液漏斗 2Br-+Cl2=Br2+2C1- Cl2+2OH-=H2O+Cl-+ClO- 溶液分层,下层液体为紫红色 氯气能够氧化溴离子和碘离子,氯气必须少量,否则干扰了检验结果 增大
【解析】(1)同一周期元素,从左到右元素的非金属性随原子序数增大而增大;(2)元素非金属性越强,其最高价氧化物的水化物酸性越强;(3)依据氯化氢是共价化合物书写电子式;
(4)根据单质与水反应剧烈程度或最高价氧化物的水化物的碱性强弱来判断;(5)①由图可以知道,A为分液漏斗,A中发生氯气与NaBr的氧化还原反应;②NaOH溶液吸收多余氯气;③碘在四氯化碳中为紫红色;氯气能够氧化溴离子和碘离子,氯气必须少量,否则干扰了检验结果;④同主族元素从上到下,电子层、原子半径均增大,得到电子能力减弱。
详解:(1) 第三周期中元素非金属性最强的元素是Cl,原子结构示意图是![]() ;
;
(2)元素非金属性越强,其最高价氧化物的水化物酸性越强;②③⑦最高价氧化物对应水化物酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3。
(3)HCl是共价化合物,形成过程表示为:![]() 。
。
(4)比较钠和铝的金属性强弱:a. 单质的熔点不能比较,a错误;b. 化合价高低不能比较,b错误;c. 单质与水反应Na比Al剧烈,可以比较,c正确;d. 最高价氧化物的水化物的碱性NaOH比Al(OH)3强,可以比较,d正确;故选cd。
(5)①由图可以知道,A为分液漏斗,A中发生氯气与NaBr的氧化还原反应,该离子反应为:2Br-+Cl2=Br2+2C1-;
因此,本题正确答案是:分液漏斗;2Br-+Cl2=Br2+2C1-;
②NaOH溶液吸收氯气,离子方程式为:Cl2+2OH-=H2O+Cl-+ClO-;
③溴与KI反应生成碘,碘易溶于四氯化碳,充分振荡、静置,可观察到溶液分层,上层几乎无色,下层呈紫红色,因此,本题正确答案是:溶液分层,上层几乎无色,下层呈紫红色;若通入过量氯气,剩余的氯气能够进入试管氧化碘离子,干扰了溴与碘离子的反应,所以氯水滴加少量的原因是:氯气能够氧化溴离子和碘离子,氯气必须少量,否则干扰了检验结果;
因此,本题正确答案是:氯气能够氧化溴离子和碘离子,氯气必须少量,否则干扰了检验结果。
④同主族元素从上到下,电子层、原子半径均增大,得到电子能力减弱;
因此,本题正确答案是:增大。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是( )
A. 金属钠露置在空气中,光亮表面颜色变暗:4Na+O2=2Na2O
B. 硫酸铵溶液与氢氧化钡溶液混合后加热,产生气体:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
C. 铝条插入烧碱溶液中,开始没有明显现象:Al2O3+2OH-=2AlO2-+H2O
D. 碘化银悬浊液滴加硫化钠溶液,黄色沉淀变成黑色:2AgI+S2-=Ag2S+2I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g)2NH3(g)△H<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
图示 |
|
|
|
|
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“达菲”瑞士罗氏制药公司生产的一种治疗禽流感和甲型H1N1流感(猪流感)的特效药.达菲的主要有效成分莽草酸是从中国百姓常见的调味料八角茴香中提取出来的.莽草酸的结构式如图,下列说法正确的是( )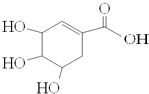
A.它能使溴水褪色
B.遇FeCl3溶液呈紫色
C.它不能发生消去反应
D.1mol莽草酸跟足量的钠反应可以得到4molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学进行如下实验,以探究化学反应中的能量变化。
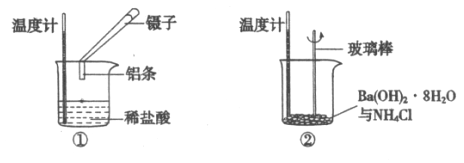
(1)实验表明:②中的温度降低,由此判断氢氧化钡晶体与氯化铵晶体反应是____________(填“吸热”或“放热”)反应。
(2)实验①中,该小组同学在烧杯中加入5 mL 1.0 mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,如图A所示,该反应是________(填“吸热”或“放热”)反应,其能量变化可用下图中的___________(填“B”或“C”)表示。

A中0—t1段化学反应速率变化的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于密闭容器中的可逆反应:mX(g)+nY(s) ![]() pZ(g) ΔH<0,达到化学平衡后,改变条件,下列表述不正确的是( )
pZ(g) ΔH<0,达到化学平衡后,改变条件,下列表述不正确的是( )
A.增大压强,化学平衡不一定发生移动
B.通入氦气,化学平衡不一定发生移动
C.增加X或Y的物质的量,化学平衡一定发生移动
D.其它条件不变,升高温度,化学平衡一定发生移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的某溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如图:下列有关推断不正确的是( )
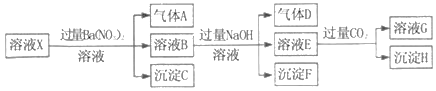
A. 溶液X中一定含有H+、Al3+、NH4+、Fe2+、SO42﹣
B. 根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl﹣
C. 沉淀H为Al(OH)3、BaCO3的混合物
D. 若溶液X为100mL,产生的气体A为44.8mL(标准状况),则X中c(Fe2+)=0.06molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
①![]() 与
与![]() 是不同的核素,因此分别由这两种原子构成的
是不同的核素,因此分别由这两种原子构成的![]() 2与
2与![]() 2化学性质不同
2化学性质不同
②![]() 2、
2、![]() 2、
2、![]() 2互为同位素,
2互为同位素,![]()
③C60与12C、14C互为同位素
④科学家已发现了H3分子,H2与H3互为同素异形体
⑤稀土元素![]() 与
与![]() 的质量数不同,属于两种元素
的质量数不同,属于两种元素
⑥H2O与D2O互称同素异形体
⑦![]() 和
和![]() 质子数相同,互为同位素
质子数相同,互为同位素
A. ④⑥ B. ③⑦ C. ②⑤ D. ④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常所说的三大材料是指金属材料、无机非金属材料和有机高分子材料.下述材料中全部属于金属材料的是( )
A.玻璃、陶瓷、水泥
B.塑料,合成纤维、橡胶
C.青铜、碳素钢、硬铝
D.玻璃钢、聚乙烯、超导陶瓷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com