

分析 方法一:化学法
(1)在利用化学法处理时,FeSO4把废水中Cr2O72-还原成Cr3+,而亚铁离子被氧化成铁离子,根据元素守恒和电荷守恒书写离子方程式;
(2)在化学法处理时,根据电子得失守恒可知关系式3FeSO4•7H2O~CrO3,据此可计算加入FeSO4•7H2O的质量与废水中CrO3质量的关系,由于FeSO4•7H2O中亚铁离子易被空气中氧气氧化,所以在使用时FeSO4•7H2O要适当过量;
方法二:电解法的工艺流程:在含有Cr2O72-的工业酸性废水中加入氯化钠,以达到增强导电性的目的,用铁作阳极电解,阳极上铁放电生成亚铁离子,亚铁离子再还原Cr2O72-生成Cr3+,溶液的pH值逐渐升高,溶液中铁离子和铬离子生成Cr(OH)3、Fe(OH)3沉淀,而达到处理污水的目的,为使溶液中部分Fe(OH)2能生成氢氧化铁沉淀,可以通入空气,以达到除铁的目的,根据Ksp=c(Cr3+)•c3(OH-)可计算出要使c(Cr3+)降至l0-5mol/L,溶液的pH值,据此答题.
解答 解:方法一:化学法
(1)在利用化学法处理时,FeSO4把废水中Cr2O72-还原成Cr3+,而亚铁离子被氧化成铁离子,反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++7H2O+6Fe3+,
故答案为:Cr2O72-+6Fe2++14H+=2Cr3++7H2O+6Fe3+;
(2)在化学法处理时,根据电子得失守恒可知关系式3FeSO4•7H2O~CrO3,所以加入FeSO4•7H2O的质量与废水中CrO3质量的比值为$\frac{3×(152+126)}{100}$=8.34,由于FeSO4•7H2O中亚铁离子易被空气中氧气氧化,所以在使用时FeSO4•7H2O要适当过量,要大于理论用量,
故答案为:8.34;大于;因绿矾易被氧化,故实际用量比理论值大;
方法二:电解法的工艺流程:在含有Cr2O72-的工业酸性废水中加入氯化钠,以达到增强导电性的目的,用铁作阳极电解,阳极上铁放电生成亚铁离子,亚铁离子再还原Cr2O72-生成Cr3+,溶液的pH值逐渐升高,溶液中铁离子和铬离子生成Cr(OH)3、Fe(OH)3沉淀,而达到处理污水的目的,为使溶液中部分Fe(OH)2能生成氢氧化铁沉淀,可以通入空气,以达到除铁的目的,根据Ksp=c(Cr3+)•c3(OH-)可计算出要使c(Cr3+)降至l0-5mol/L,溶液的pH值,
(3)根据上面的分析可知,加入适量食盐的作用为 增加污水中离子浓度,增强导电能力,选择Fe做阳极,生成的亚铁离子为还原剂,在酸性溶液中与Cr2O72-离子发生氧化还原反应使Cr2O72-离子被还原成Cr3+,
故答案为:增加污水中离子浓度,增强导电能力;阳极;生成的亚铁离子为还原剂,在酸性溶液中与Cr2O72-离子发生氧化还原反应使Cr2O72-离子被还原成Cr3+;
(4)在电解过程中,阴极发生的反应为2H++2e-=H2↑,所以随着电解和溶液中反应的进行,阴极区溶液pH 变大,鼓入空气的原因是在处理过程中鼓入空气中的O2充分与Fe(OH)2反应,成为容易分离得Cr(OH)3、Fe(OH)3,使废水含铬量降到可排放标准,
故答案为:;在处理过程中鼓入空气中的O2充分与Fe(OH)2反应,成为容易分离得Cr(OH)3、Fe(OH)3,使废水含铬量降到可排放标准;
(5)要使c(Cr3+)降至l0-5mol/L,根据Ksp=c(Cr3+)•c3(OH-)可知,c(OH-)=$\root{3}{\frac{Ksp}{c(Cr{\;}^{3+})}}$=$\root{3}{\frac{10{\;}^{-32}}{l0{\;}^{-5}}}$=10-9 mol/L,所以pH=5,
故答案为:5.
点评 本题以工业废水处理为载体,考查氧化还原反应、离子反应、电解池原理、沉淀溶解平衡的计算等,难度中等,关键根据实验流程利用氧化还原反应判断发生的离子反应,是对学生综合能力的考查.


科目:高中化学 来源: 题型:选择题
| A. | 1.1 mol•l-1 | B. | 1.5mol•L-1 | C. | 2.4 mol•L-1 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60% | B. | 75% | C. | 80% | D. | 85% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非自发的氧化还原反应不可以设计成原电池 | |
| B. | 将反应 3Cu+8HNO3═3Cu(NO3)2+2NO+4H2O 设计成原电池,其正极反应为:2NO3-+6e-+8H+═2NO+4H2O | |
| C. | 铅蓄电池工作时,正极、负极质量均增加 | |
| D. | 氢氧燃料电池耗H20.1mol时,电路中流经的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 溴乙烷是有机合成中的重要原料,实验室合成溴乙烷的装置示意图、相关原理和数据如下:
溴乙烷是有机合成中的重要原料,实验室合成溴乙烷的装置示意图、相关原理和数据如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解度 | |
| 乙 醇 | 46 | 0.789 | 78.3 | 易溶 |
| 溴乙烷 | 109 | 1.46 | 38.2 | 难溶 |
| 浓硫酸(H2SO4) | 98 | 1.84 | 338.0 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
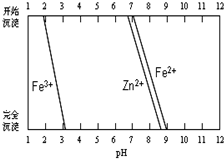 铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
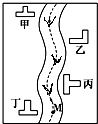 在一条鱼、虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示).它们所排出的废液里每厂只含有NaHCO3、FeCl3、Ca(OH)2、HCl中的一种.某环保小组对河水监测时发现
在一条鱼、虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示).它们所排出的废液里每厂只含有NaHCO3、FeCl3、Ca(OH)2、HCl中的一种.某环保小组对河水监测时发现查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com