
| A、98%的浓硫酸 |
| B、浓盐酸 |
| C、澄清石灰水 |
| D、硫酸钠晶体 |
科目:高中化学 来源: 题型:
| A、铁 | B、铜 | C、碘 | D、磷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所有铵盐受热均可以分解,产物均有NH3 |
| B、硝酸铵受热易分解爆炸,实验室常加热氯化铵与氢氧化钙的混合物制备氨气 |
| C、在盛有硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液的试管中,滴加少量NaOH溶液,在试管口用湿润的红色石蕊试纸检验,试纸变蓝 |
| D、铵盐都易溶于水,其水溶液均呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(H2)=0.3 mol?L-1?min-1 |
| B、v(N2)=0.2 mol?L-1?min-1 |
| C、v(NH3)=0.3 mol?L-1?min-1 |
| D、v(H2)=0.005 mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应的限度决定于反应物的性质,与外界条件无关 |
| B、合成氨反应在一定条件下达到平衡后,N2、H2、NH3物质的量之比保持恒定 |
| C、增大反应物的用量一定会加快反应速率 |
| D、浓度、温度、压强、催化剂既是影响反应速率的因素又是影响反应限度的因素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
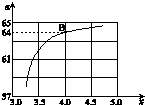 氨气是生产氮肥、硝酸、纯碱等的重要原料.
氨气是生产氮肥、硝酸、纯碱等的重要原料.| N2 | H2 | NH3 | |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| n(NH3) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
| B、ab | ||
C、
| ||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com