
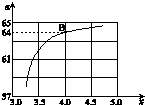
 氨气是生产氮肥、硝酸、纯碱等的重要原料.
氨气是生产氮肥、硝酸、纯碱等的重要原料.| N2 | H2 | NH3 | |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| n(NH3) |
| n(CO2) |
| 1.28 |
| 4 |


科目:高中化学 来源: 题型:
查看答案和解析>>
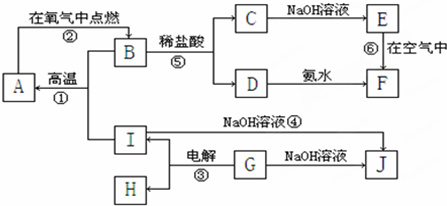
科目:高中化学 来源: 题型:
| A、硫铁矿燃烧前需要粉碎,因为块状硫铁矿不能燃烧 |
| B、SO2氧化为SO3需要高压,可以提高SO2的转化率 |
| C、SO2氧化为SO3需要使用催化剂,可以提高SO2的转化率 |
| D、用98.3%的浓硫酸吸收SO3,可以提高SO3的吸收效率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、全部 | B、只有①③⑤ |
| C、只有②④⑥ | D、只有①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钢铁发生电化学腐蚀时,负极发生的反应是2H2O+O2+4e-=4 OH- |
| B、在空气中,金属铝表面能迅速被氧化形成保护膜,因此铝不容易被腐蚀 |
| C、铸铁输油管道应埋在干燥致密不透气的土壤中 |
| D、白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、④⑤⑥ | B、①②③④ |
| C、①③④ | D、①③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com