
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
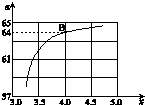 氨气是生产氮肥、硝酸、纯碱等的重要原料.
氨气是生产氮肥、硝酸、纯碱等的重要原料.| N2 | H2 | NH3 | |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| n(NH3) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
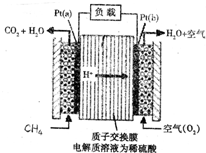 科学家预言,燃料电池将是21世纪获得电源的重要途径.近几年开发的甲烷燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过.其工作原理的示意图如图:
科学家预言,燃料电池将是21世纪获得电源的重要途径.近几年开发的甲烷燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过.其工作原理的示意图如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜锌原电池中,电子由锌极经导线流向铜极 |
| B、铜锌原电池中,锌作阳极,铜作阴极 |
| C、石墨电极电解氯化铜溶液的反应中,阳极上质量增重 |
| D、石墨电极电解氯化钠溶液的反应中,用氢氧化钠溶液吸收阴极产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
| B、ab | ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电子的运动与行星相似,围绕原子核在固定的轨道上高速旋转 |
| B、能量低的电子只能在s轨道上运动,能量高的电子总是在f轨道上运动 |
| C、能层序数越大,s原子轨道的半径越大 |
| D、在同一能级上运动的电子,其运动状态肯定不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com