
【题目】雾霾的形成与汽车尾气和燃煤有直接的关系,新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害。
(1)用SO2气体可以消除汽车尾气中NO2, 已知NO2(g)+SO2(g)![]() SO3(g)+NO(g)。一定条件下,将NO2与SO2以物质的量比1∶2置于体积为1L 密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=____。
SO3(g)+NO(g)。一定条件下,将NO2与SO2以物质的量比1∶2置于体积为1L 密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=____。
(2)目前降低尾气中的NO和CO可行方法是在汽车排气管上安装催化转化器。NO和CO在催化转换器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-a kJ·mol-1。在25℃和101kPa下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
N2(g)+2CO2(g) △H=-a kJ·mol-1。在25℃和101kPa下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:

①有害气体NO的转化率为________。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是_____(选填序号)。
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
(3)消除汽车尾气中NO2也可以用CO,已知2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;CO的燃烧热△H=-c kJ·mol-1。写出消除汽车尾气中NO2的污染时,NO2与CO的反应的热化学反应方程式 ____________________。
(4)已知NH3·H2O的Kb=2.0 ×10-5
①求0.10 mol/L的 NH3·H2O的c(OH-)=______________mol/L
②若向其中加入固体NH4Cl,使c(NH4+)的浓度达到0.20 mol/L,则c(OH-)=______mol/L。
【答案】 2.67(8/3) 40% c d 4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) △H=-a+b-2c kJ·mol-1 1.4×10-3 1 ×10-5
N2(g)+4CO2(g) △H=-a+b-2c kJ·mol-1 1.4×10-3 1 ×10-5
【解析】试题分析:(1)利用“三段式”计算NO2(g)+SO2(g)![]() SO3(g)+NO(g) 的平衡常数;(2)①有害气体NO的转化率=NO的变化量÷NO的初始量×100%;②根据影响化学平衡的因素进行判断;(3)根据盖斯定律计算NO2与CO的反应热;(4)根据Kb=
SO3(g)+NO(g) 的平衡常数;(2)①有害气体NO的转化率=NO的变化量÷NO的初始量×100%;②根据影响化学平衡的因素进行判断;(3)根据盖斯定律计算NO2与CO的反应热;(4)根据Kb=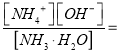 2.0 ×10-5计算c(OH-);
2.0 ×10-5计算c(OH-);
解析:(1)将NO2与SO2以物质的量比1∶2置于体积为1L 密闭容器中,设开始时NO2的浓度为amol/L,则SO2的浓度为2amol/L;NO2浓度变化为xmol/L;
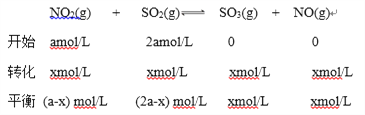
(a-x) mol/L:(2a-x) mol/L=1:6;
x=0.8a
![]() ;
;
(2)①将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,NO、CO的浓度分别是1 mol/L、1.2mol/L,根据图示,平衡时CO浓度的变化量为0.4 mol/L,则有害气体NO的浓度变化量是0.4 mol/L,NO的转化率是![]() ;
;
②a.缩小容器体积,压强增大,平衡向正反应方向移动,但平衡时CO浓度大于第一次平衡浓度,故a错误; b.增加CO的量,平衡向正反应方向移动,但CO的浓度增大,故b错误; c.降低温度,平衡向正反应方向移动,则CO的浓度减小,故c正确;d.扩大容器体积,压强减小,平衡向逆反应方向移动,但平衡时CO浓度小于第一次平衡浓度,故d正确;
(3)CO的燃烧热△H=-c kJ·mol-1,即①CO(g)+![]() O2(g)= CO2(g)△H=-c kJ·mol-1 。
O2(g)= CO2(g)△H=-c kJ·mol-1 。
② 2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;
③ 2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-a kJ·mol-1;
N2(g)+2CO2(g) △H=-a kJ·mol-1;
根据盖斯定律,③-②+①×2得 4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) △H=-a+b-2c kJ·mol-1;
N2(g)+4CO2(g) △H=-a+b-2c kJ·mol-1;
(4)①根据Kb=
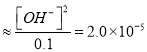 ,c(OH-)=1.4×10-3;
,c(OH-)=1.4×10-3;
②若向其中加入固体NH4Cl,氯化铵抑制氨水电离, ![]() 接近0.1mol/L,根据
接近0.1mol/L,根据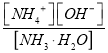 =2.0 ×10-5,
=2.0 ×10-5, ![]() 2.0 ×10-5, c(OH-)=1×10-5。
2.0 ×10-5, c(OH-)=1×10-5。


科目:高中化学 来源: 题型:
【题目】在一个密闭容器中盛有N2和H2 , 它们的起始浓度分别是1.8mol/L和5.4mol/L,在一定的条件下它们反应生成NH3 , 10min后测得N2的浓度是0.8mol/L,则在这10min内NH3的平均反应速率是( )
A.0.1 mol/(Lmin)
B.0.2 mol/(Lmin)
C.0.3 mol/(Lmin)
D.0.6 mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途的叙述中,二者不具有对应关系的是
A. NH3易溶于水,可用作制冷剂
B. SO2具有漂白性,可用来漂白纸浆
C. 浓硫酸具有吸水性,可用作干燥剂
D. 漂白粉具有氧化性,可用作环境消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,常温下H2S、H2CO3 的电离常数如下表
Ka1 | Ka2 | |
H2S | 9.1×10-8 | 1×10-15 |
H2CO3 | 4.3×10-7 | 5.6×10-11 |
(1)①常温下,0.1mol/L的硫化钠溶液和0.1mol.L-1的碳酸钠溶液,碱性更强的是_______。其原因是_____________________________。
② 常温下,硫化钠水解的离子方程式_____________________________。
(2)H2S能与许多金属离子发生反应,生成溶解度不同和各种颜色的金属硫化物沉淀,可用于分离和鉴定金属离子。
①常温下,NaHS溶液显______(选填“酸性”、“中性”或“碱性”)
②常温下,向100 mL 0.1 mol·L-1 H2S溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:

试分析图中a、b、c、d四个点,水的电离程度最大的是________;在b点,溶液中各离子浓度由大到小的排列顺序是______________________________。
(3)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源,该部分硫化氢用过量NaOH溶液吸收后,再以石墨作电极电解该溶液可回收硫,写出电解得到硫的总反应方程式(忽略氧的氧化还原)_______________;从整个生产工艺的角度分析,该方法不仅能减少环境污染、回收硫、得到一定量的副产物,还具有的优点是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某次硫酸铜晶体结晶水含量的测定实验中,相对误差为+2.7%,其原因不可能是( )
A.实验时坩埚未完全干燥B.加热后固体未放入干燥器中冷却
C.加热过程中晶体有少量溅失D.加热后固体颜色有少量变黑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在指定分散系中可以大量共存的粒子组是:
A.在空气中:H2 、NH3、NO 、CO2
B.在K2CO3溶液中:Na+、H+、Cl-、Br-
C.在无水乙醇的CCl4溶液中:Br2、I2、苯、甲醇
D.在Fe(NO3)3溶液中:H+、SO42-、I-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有些酶必需在某些特定物质存在的条件下才具有活性。下列是有关某种酶的实验,处理方式及结果如下表及下图所示。根据结果判断,叙述不正确的是( )
试管I | 试管II | 试管III | |
某酶 | 1mL | 1mL | 1mL |
pH | 8 | 8 | 7 |
温度 | 80℃ | 40℃ | 40℃ |
反应物 | 1mL | 1mL | 1mL |
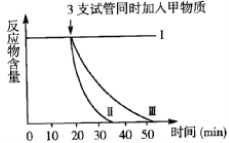
A.甲物质可能激发该酶的活性
B.35分钟后试管Ⅱ中反应物已被消耗殆尽
C.该酶在80℃的环境下已经失活
D.该酶在中性环境中的活性比在弱碱性环境中高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7是一种橙红色具有强氧化性的化合物,当它在酸性条件下被还原成正三价铬时,颜色变为绿色.据此,当交警发现汽车行驶不正常时,就可上前阻拦,并让司机对填充了吸附有K2Cr2O7的硅胶颗粒的检验装置吹气.若发现硅胶变色达到一定程度,即可证明司机是酒后驾车.这时酒精被氧化为醋酸其反应原理如下:
2K2Cr2O7+3CH3CH2OH+8H2SO4=2K2SO4+2Cr2(SO4)3+3CH3COOH+11H2O
请结合上面的描述回答下列问题:
(1)将上述反应改写为离子方程式:
(2)如果司机属于醉酒驾车,则检验装置中的硅胶将由色变为色
(3)上述反应中氧化剂是 , 还原产物是(本题中的两个空都需填写物质的化学式)
(4)在上述反应中当有69g酒精发生反应时消耗K2Cr2O7的物质的量是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com