
【题目】有研究表明,内源性H2S作为气体信号分子家族新成员,在抗炎、舒张血管等方面具有重要的生理作用,而笼状COS(羰基硫)分子可作为H2S的新型供体(释放剂)。试回答下列有关问题
(1)COS的分子结构与CO2相似,COS的结构式为______。
(2)已知:①COS(g)+H2(g)H2S(g)+CO(g)△H1=-15kJmol-1,②COS(g)+H2(g)H2S(g)+CO2(g)△H2=-36kJmol-1,③CO(g)+H2O(g)H2(g)+CO2(g)△H3,则△H=______。
(3)COS可由CO和H2S在一定条件下反应制得。在恒容的密闭容器中发生反应并达到平衡:CO(g)+H2S(g)COS(g)+H2(g),数据如表所示、据此填空
实验 | 温度/℃ | 起始时 | 平衡时 | |||
n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | x |
3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
①该反应为______(选填“吸热反应”或“放热反应”)。
②实验2达到平衡时,x______7.0(选填“>”、“<”或“=”)
③实验3达到平衡时,CO的转化率α=______
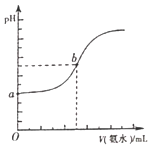
(4)已知常温下,H2S和NH3H2O的电离常数分别为向pH=a的氢硫酸中滴加等浓度的氨水,加入氨水的体积(V)与溶液pH的关系如图所示:
酸/碱 | 电离常数 | |
H2S | Ka1=1.0×10-7 | Ka2=7.0×10-15 |
NH3H2O | Kb=1.0×10-5 | |
①若c(H2S)为0.1mol/L,则a=______
②若b点溶液pH=7,则b点溶液中所有离子浓度大小关系是______。
(5)将H2S通入装有固体FeCl2的真空密闭烧瓶内,恒温至300℃,反应达到平衡时,烧瓶中固体只有FeCl2和FeSx(x并非整数),另有H2S、HCl和H2三种气体,其分压依次为0.30P0、0.80P0和0.04P0(P0表示标准大气压)。当化学方程式中FeCl2的计量数为1时,该反应的气体压强平衡常数记为Kp。计算:
①x=______(保留两位有效数字)。
②Kp=______(数字用指数式表示)。
【答案】O=C=S 21kJmol-1 放热反应 < 20% 4 c(NH4+)>c(HS-)>c(H+)=c(OH-)>c(S2-) 1.1 ![]()
【解析】
(1)CO2和COS是等电子体,等电子体结构相似,根据二氧化碳的分子的结构式可知COS结构式;
(2)根据盖斯定律计算可得;
(3)①分别建立三段式计算实验1和实验3的化学平衡常数,依据平衡常数的大小判断反应时放热还是吸热;
②通过浓度熵与平衡常数的大小判断平衡移动方向;
③依据三段式和转化率公式计算;
(4)①依据电离常数公式计算;
②依据电离程度和水解程度的相对大小判断;
(5)依据题给信息写出反应的化学方程式,由题给数据和公式计算即可。
(1)由二氧化碳分子的结构式可知:COS分子中C与O、C与S均形成两对共有电子对,所以COS结构式为:O=C=S,故答案为:O=C=S;
(2)盖斯定律②-①得到CO(g)+H2O(g)H2(g)+CO2(g)的焓变△H3=-36kJmol-1-(-15kJmol-1)=-21kJmol-1,故答案为:-21kJmol-1;
(3)设容器体积为1L。
①由题意可建立实验1反应的三段式为:
CO(g)+H2S(g)COS(g)+H2(g)
开始(mol/L)10.010.000
反应(mol/L)3.0 3.0 3.0 3.0
平衡(mol/L)7.0 7.0 3.0 3.0
化学平衡常数=![]() =
=![]() =0.18;
=0.18;
由题意可建立实验3反应的三段式为:
CO(g)+H2S(g)COS(g)+H2(g)
开始(mol/L) 20.0 20.0 0 0
反应(mol/L) 4.04.04.0 4.0
平衡(mol/L) 16.016.0 4.0 4.0
化学平衡常数=![]() =
=![]() =0.0625<0.18,所以升高温度,平衡常数k减小,即平衡逆向移动,正向即放热反应,故答案为:放热反应;
=0.0625<0.18,所以升高温度,平衡常数k减小,即平衡逆向移动,正向即放热反应,故答案为:放热反应;
②150℃,浓度熵Qc=![]() =
=![]() ≈0.16<k=0.18,则反应向正反应方向移动,所以实验2达平衡时,n(CO)减小,x<7.0,故答案为:<;
≈0.16<k=0.18,则反应向正反应方向移动,所以实验2达平衡时,n(CO)减小,x<7.0,故答案为:<;
③实验3达平衡时,CO的转化率=![]() ×100%=
×100%=![]() ×100%=20%,故答案为:20%;
×100%=20%,故答案为:20%;
(4)①c(H+)=![]() =
=![]() mol/L=10-4mol/L,a=pH=-lg10-4=4,故答案为:4;
mol/L=10-4mol/L,a=pH=-lg10-4=4,故答案为:4;
②b点呈中性,则c(H+)=c(OH-),溶液中电荷关系为c(NH4+)+c(H+)=c(HS-)+2c(S2-)+c(OH-),所以c(NH4+)>c(HS-),由于HS-的电离程度很小、主要以电离为主,同时促进水的电离,所以c(H+)>c(S2-),即b点时溶液中所有离子浓度大小关系是c(NH4+)>c(HS-)>c(H+)=c(OH-)>c(S2-),故答案为:c(NH4+)>c(HS-)>c(H+)=c(OH-)>c(S2-);
(5)H2S和FeCl2反应的方程式为xH2S(g)+FeCl2(s)FeSx(s)+2HCl(g)+(x-1)H2(g)。
①有化学方程式可得关系式:2:(x-1)=0.80P0:0.04P0,解得x=1.1,故答案为:1.1;
②H2S和FeCl2反应的方程式为1.1H2S(g)+FeCl2(s)FeS1.1(s)+2HCl(g)+0.1H2(g),由方程式可得p(HCl)=0.80P0,p(H2)=0.04P0,p(H2S)=0.30P0,平衡分压常数Kp=![]() /span>
/span>
=![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应的离子方程式书写正确的是

A. OH+HCl=H2O+ClB. Ca(OH)2+Cu2+=Ca2++Cu(OH)2
C. Fe+Cu2+=Cu+Fe2+D. Fe+2H+=Fe3++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
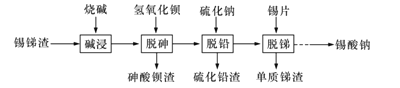
【题目】锡酸钠可用于制造陶瓷电容器的基体、颜料和催化剂。以锡锑渣(主要含Sn、Sb、As、Pb的氧化物)为原料,制备锡酸钠的工艺流程图如下图所示:
请回答下列问題:
(1)Sn(IVA)、As(VA)、Sb(VA)三种元素中,Sn的原子序数为50,其原子结构示意图为_____,碱浸”时SnO2发生反应的化学方程式为___________________________。
(2)“碱浸”时,若Sn元素氧化物中SnO含量较高,工业上则加入NaNO3,其作用是_______。
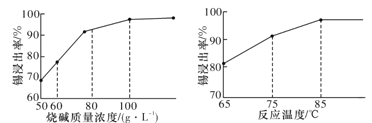
(3)从溶液中得到锡酸钠晶体的实验操作是_________、趁热过滤、洗涤、干燥。下图是“碱浸”实验的参数,请选择“碱浸”的合适条件_______。
(4)“脱铅”是从含Na2PbO2的溶液中形成硫化铅渣,其离子方程式为_________________。
(5)“脱锑”时Na2SbO4发生的化学方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂锰电池结构如图所示,其中电解质![]() 溶于混合有机溶剂中,
溶于混合有机溶剂中,![]() 通过电解质迁移入
通过电解质迁移入![]() 晶格中生成
晶格中生成![]() 。下列有关说法正确的是
。下列有关说法正确的是
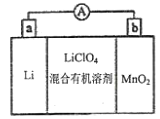
A. 外电路电流方向:a→b
B. 电池正极反应式为:![]()
C. 可以用水代替电池中的混合有机溶剂
D. 用该电池给铅蓄电池充电,a极与Pb电极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法正确的是

A. Q的氧化物一定含有离子键和共价键 B. 最高价含氧酸的酸性:Z<Y
C. P的最低价氢化物常温常压下为液体 D. Y形成的化合物种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三效催化剂是最为常见的汽车尾气催化剂,其催化剂表面物质转化的关系如图所示,下列说法正确的 ( )
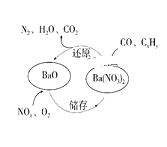
A.在转化过程中,氮元素均被还原
B.依据图示判断催化剂不参与储存和还原过程
C.还原过程中生成0.1mol N2,转移电子数为0.5 NA
D.三效催化剂能有效实现汽车尾气中CO、CxHy、NOx三种成分的净化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的键线式如图所示,下列关于该有机物的描述不正确的是
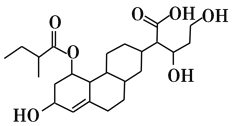
A.含有4种官能团
B.能发生取代、加成、酯化、氧化、还原等反应
C.1mol该物质最多可与3molH2发生加成反应
D.该有机物与Na、NaOH、Na2CO3均能反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍及其化合物的应用正日益被重视。
(1)最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子价电子的排布图为_______。
(2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有_____(填字母)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液pH均小于7
(3)铍、铝晶体都是由金属原子密置层在三维空间堆积而成(最密堆积)。铍的熔点(1551K)比铝的熔点(930K)高,原因是____。
(4)氯化铍在气态时存在BeCl2分子(a)和二聚分子(BeCl2)2(b),固态时则具有如下图所示的链状结构(c)。
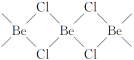
①a属于____(填“极性”或“非极性”)分子。
②二聚分子(BeCl2)2中Be原子的杂化方式相同,且所有原子都在同一平面上。b的结构式为____(标出配位键)。
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所:
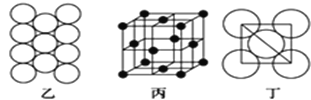
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为___个;Al晶体的密度为_____(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y在周期表中的相对位置如图所示,且已知X基态原子的价电子排布为nsnnpn+1,下列说法不正确的是( )
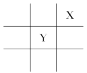
A. X元素的电负性大于YB. X元素的第一电离能大于Y
C. X在周期表中位于第二周期第ⅢA族D. 原子半径Mg>Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com