
【题目】辉钼精矿主要成分是二氧化钼(MoS2),还含有石灰石、石英、黄铜矿(CuFeS2)等杂质。某学习小组设计提取MoS2的过程如下:下列说法错误的是
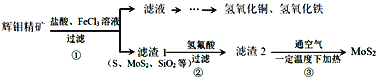
A.为加快辉钼精矿溶解,可将矿石粉粹并适当加热
B.加滤液中含Ca2+、Fe2+、Fe3+、Cu2+、H+等离子
C.以上①②③过程均涉及氧化还原反应
D.步骤③温度不宜过高,以免MoS2被氧化
【答案】C
【解析】
辉钼精矿经盐酸、氯化铁浸泡时,碳酸钙黄铜矿溶解,则滤液中含有Ca2+、Fe2+、Fe3+、Cu2+、H+等离子;滤渣为S、MoS2、SiO2;加入氢氟酸,二氧化硅反应生成四氟化硅气体和水,滤渣2为S、MoS2,空气中加入S生成二氧化硫。
A.可将矿石粉粹增大接触面积并适当加热,可使反应速率增大,促使辉钼精矿加快溶解,与题意不符,A错误;
B. 分析可知,滤液中含Ca2+、Fe2+、Fe3+、Cu2+、H+等离子,与题意不符,B错误;
C. 反应②的过程为二氧化硅与氢氟酸反应生成四氟化硅气体和水,为复分解反应,符合题意,C正确;
D. 步骤③温度不宜过高,以免MoS2被氧化,与题意不符,D错误;
答案为C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】1 mol某有机物在稀硫酸作用下,水解生成2 mol相同的物质。有下列物质:
①蔗糖 ②麦芽糖 ③淀粉 ④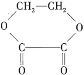 ⑤
⑤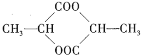
⑥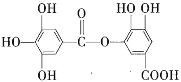 ⑦
⑦![]()
其中符合此题目要求的是( )
A.②⑤⑥⑦B.②④⑤⑦C.①②⑤⑦D.①④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)基态钛原子的价电子排布式为_____________,与钛同周期的元素中,基态原子的未成对电子数与钛相同的有____________种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料,钛的硬度比铝大的原因是_________。
(3)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1:5,则该配合离子的化学式为___________。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。
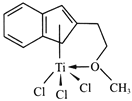
①组成M的元素中,电负性最大的是_________(填名称)。
②M中碳原子的杂化方式为____________。
③M中不含________(填代号)。
a.π键 b.σ键 c.离子键 d.配位键
(5)金红石(TiO2)是含钛的主要矿物之一。其晶胞结构(晶胞中相同位置的原子相同)如图所示。

①A、B、C、D 4种微粒,其中氧原子是________(填代号)。
②若A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,____,___);钛氧键的键长d=______(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示装置制备乙炔,并验证乙炔的某些化学性质,已知制备的乙炔气体中往往含有少量的![]() 气体。请回答下列问题:
气体。请回答下列问题:

(1)实验室制备乙炔的化学方程式为________;为了使产生乙炔的气流平稳,装置![]() 的分液漏斗中常用______________代替水。
的分液漏斗中常用______________代替水。
(2)装置![]() 中
中![]() 溶液的作用是________,发生反应的离子方程式为_________。
溶液的作用是________,发生反应的离子方程式为_________。
(3)装置![]() 中观察到的现象是__________,发生反应的化学方程式为_________,该反应是_______(填反应类型)。
中观察到的现象是__________,发生反应的化学方程式为_________,该反应是_______(填反应类型)。
(4)装置![]() 中观察到的现象是________。
中观察到的现象是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10 mL 0.1 mol/L的HR溶液中逐滴滴入0.l mol/L 的氨水,溶液pH及导电性变化如图。
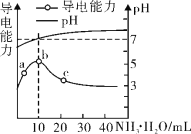
下列分析正确的是
A.HR为强酸
B.加入10 mL 氨水时,溶液中c(NH4+)>c(R-)
C.c点溶液存在c(NH4+)<c( R-)
D.b点的离子浓度大于a点的离子浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaOH溶液吸收烟气中的SO2,将所得的吸收液用三室膜电解技术处理,原理如图所示.下列说法错误的是
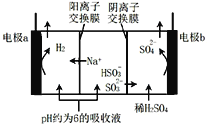
A.电极a为电解池阴极
B.阳极上有反应HSO3—-2e—+H2O=SO42—+3H+发生
C.当电路中通过1mol电子的电量时,理论上将产生0.5mol H2
D.处理后可得到较浓的H2SO4和NaHSO3产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的电子垃圾处理不当会对环境构成威胁。某研究小组将废弃的线路板处理后,得到含Cu、Al及少量Fe的金属混合物,并设计如下流程制备硫酸铜和硫酸铝晶体。

请回答:
(1)步骤①~③所涉及的实验操作方法中,属于过滤的是______(填序号)。
(2)步骤①中Cu、Al、Fe均能与稀硫酸和浓硝酸的混合物在加热条件下反应,其中氮元素全部转化为NO。该步骤中稀硫酸的作用是______。
(3)下列关于步骤②的说法正确的是______(填字母)。
a 沉淀B为白色固体
b H2O2的作用是将Fe2+氧化为Fe3+
c 可以用Ba(OH)2溶液替换NaOH溶液
(4)已知AlO2-+ 4H+=Al3+ + 2H2O。由沉淀B制取Al2(SO4)3·18H2O的操作是:将沉淀B转移到烧杯中,______,将溶液加热蒸发、冷却结晶、过滤得到产品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电化学法生产硫酸的工艺示意图如图,电池以固体金属氧化物作电解质,该电解质能传导O2-离子,已知S(g)在负极发生的反应为可逆反应,则下列说法正确的是( )
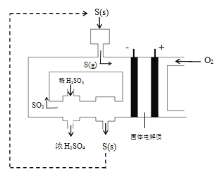
A.在负极S(g)只发生反应S-6e-+3O2-=SO3
B.该工艺用稀硫酸吸收SO3可提高S(g)的转化率
C.每生产1L浓度为98%,密度为1.84g/mL的浓硫酸,理论上将消耗30mol氧气
D.工艺中稀硫酸浓度增大的原因是水参与电极放电质量减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的有机产物,肯定是一种的是( )
A. 异戊二烯(![]() )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
B. 2—氯丁烷(![]() )与NaOH溶液共热发生反应
)与NaOH溶液共热发生反应
C. 甲苯在一定条件下发生硝化生成一硝基甲苯的反应
D. 等物质的量的甲烷和氯气的混和气体长时间光照后的产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com