
【题目】工业上电化学法生产硫酸的工艺示意图如图,电池以固体金属氧化物作电解质,该电解质能传导O2-离子,已知S(g)在负极发生的反应为可逆反应,则下列说法正确的是( )
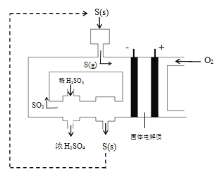
A.在负极S(g)只发生反应S-6e-+3O2-=SO3
B.该工艺用稀硫酸吸收SO3可提高S(g)的转化率
C.每生产1L浓度为98%,密度为1.84g/mL的浓硫酸,理论上将消耗30mol氧气
D.工艺中稀硫酸浓度增大的原因是水参与电极放电质量减少
科目:高中化学 来源: 题型:
【题目】在容积为1 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的ΔH_____0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在 0~60 s 时段, 反应速率 v(N2O4)为_____mol·L-1·s-1;反应的平衡转化率为:_____; 反应的平衡常数K1为_____。
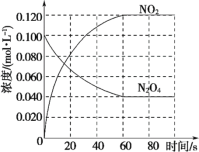
(2)100℃时达平衡后,改变反应温度为 T,N2O4以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
a:T____________100℃(填“大于”或“小于”),判断理由是__________。
b:计算温度T时反应的平衡常数K2____________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半。平衡向____________(填“正反应”或“逆反应”)方向移动,判断理由________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉钼精矿主要成分是二氧化钼(MoS2),还含有石灰石、石英、黄铜矿(CuFeS2)等杂质。某学习小组设计提取MoS2的过程如下:下列说法错误的是
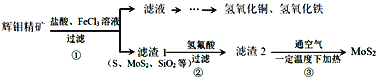
A.为加快辉钼精矿溶解,可将矿石粉粹并适当加热
B.加滤液中含Ca2+、Fe2+、Fe3+、Cu2+、H+等离子
C.以上①②③过程均涉及氧化还原反应
D.步骤③温度不宜过高,以免MoS2被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是化学电源的雏形。关于如图所示原电池的说法正确的是
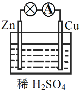
(1)如图连接好装置后,负极材料是__(填“Zn”或“Cu”),铜电极发生的现象:_____。
(2)相应原电池的总反应方程式为____。
(3)下列化学反应可通过原电池装置,可实现化学能直接转化为电能的是__(填序号)
①2NaOH+H2SO4=Na2SO4+2H2O
②Cu+2Fe3+=Cu2++2Fe2+
③C2H5OH+3O2![]() 2CO2+3H2O
2CO2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热催化合成氨面临的两难问题是:釆用高温增大反应速率的同时会因平衡限制导致NH3产率降低。我国科研人员研制了TiHFe双温区催化剂(Ti-H区域和Fe区域的温度差可超过100℃)。Ti-H-Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是( )
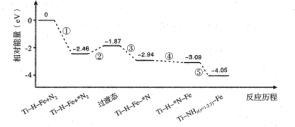
A.①为氮氮三键的断裂过程
B.①②③在低温区发生,④⑤在高温区发生
C.使用Ti-H-Fe双温区催化剂使合成氨反应转变为吸热反应
D.④为N原子由Fe区域向Ti-H区域的传递过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在0.10mol/LH2A溶液中滴入0.10mol/LNaOH溶液,滴定曲线如图所示。下列说法正确的是( )
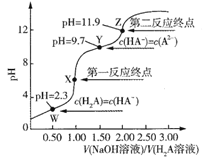
A.该滴定过程应该选择石蕊作为指示剂
B.X点溶液中:c(H2A)+c(H+)=c(A2-)+2c(OH-)
C.Y点溶液中:3c(Na+)=2c(A2-)+2c(HA-)+2c(H2A)
D.0.01mol/LNa2A溶液的pH约为10.85
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某届奥运会上,有个别运动员因服用兴奋剂被取消参赛的资格。下图是检测出兴奋剂的某种同系物X的结构,关于X的说法正确的是( )
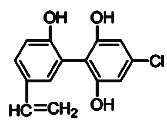
A.X分子中不可能所有原子都在同一平面上
B.X 遇到FeCl3溶液时显紫色,而且能使溴的四氯化碳溶液褪色
C.1 mol X 与足量的浓溴水反应,最多消耗5 mol Br2
D.1 mol X在一定条件下与足量的氢气反应,最多消耗1 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国是稀土资源大国,稀土是化学元素周期表中镧系元素和钪、钇共十七种金属元素的总称,被誉为“万能之土”。某小组以钇矿石(Y2FeBe2Si2O10)为主要原料制备氧化钇(Y2O3)和铍的流程(部分条件和产物省略)如图所示:
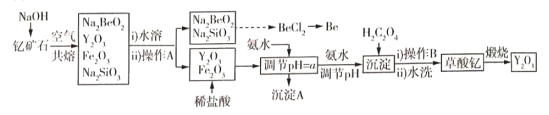
已知部分信息如下:
①铍、铝的单质及其化合物的化学性质相似;
②稀土元素都是活泼金属,性质相似,常见化合价为+3;
③Fe3+ Y3+形成的氢氧化物沉淀的pH范围如表所示:
离子 | Fe3+ | Y3+ |
开始沉淀的PH | 2.1 | 6.0 |
完全沉淀的PH | 3.1 | 8.3 |
请回答下列问题:
(1)沉淀A的主要成分是______(填化学式);操作A的名称是____________________。
(2)钇矿石与氢氧化钠共熔反应中的氧化产物为__________;写出加入草酸生成沉淀的离子方程式:___________;草酸钇隔绝空气煅烧的方程式______________。
(3)调节pH=a,则a的范围为______________。
(4)已知常温下;K[Y(OH)3]=1.0×10-23。Y3++3H2O=Y(OH)3+3H+平衡常数为K,则pK=-lgK=_____。
(5)叙述由Na2SiO3和Na2BeO3溶液制取BeCl2固体的过程:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃是一类重要的有机合成中间体,是许多有机合成的原料.根据卤代烃的相关性质,回答下列问题.
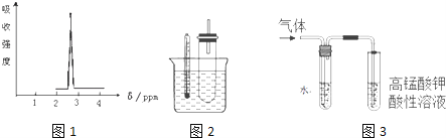
(1)化合物A的分子式是C3H6Br2,A的氢核磁共振氢谱图如图1所示,则A的结构简式为___________.
(2)某同学用如图2装置(铁架台、酒精灯等略)验证取代反应和消去反应的产物
实验操作Ⅰ:在试管中加入5mL1mol/LNaOH溶液和0.5mL溴乙烷振荡.
实验操作Ⅱ:将试管如图2固定后,水浴加热.
①据图1:用水浴加热而不直接用酒精灯加热的原因2是________.
②图3是为证明溴乙烷在NaOH乙醇溶液中加热发生的是消去反应.
i实验中需要检验的产物是_______,水的作用是__________,实验现象是_________________.
ii若将“酸性高锰酸钾溶液”换成“Br2的CCl4溶液”,还需要装水的洗气装置吗________?(填“需要”或“不需要”),理由是________.
iii所检验的产物与Br2的CCl4溶液反应的化学方程式为___________.
(3)已知:
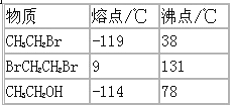
分离溴乙烷与1,2-二溴乙烷混合气体的方法是____________.
a.冰水浴冷却→过滤
b.水浴冷却→蒸馏
c.冰水浴冷却→加水萃取→分液
d.水浴冷却→加水萃取→分液.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com