
【题目】原电池是化学电源的雏形。关于如图所示原电池的说法正确的是
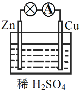
(1)如图连接好装置后,负极材料是__(填“Zn”或“Cu”),铜电极发生的现象:_____。
(2)相应原电池的总反应方程式为____。
(3)下列化学反应可通过原电池装置,可实现化学能直接转化为电能的是__(填序号)
①2NaOH+H2SO4=Na2SO4+2H2O
②Cu+2Fe3+=Cu2++2Fe2+
③C2H5OH+3O2![]() 2CO2+3H2O
2CO2+3H2O
【答案】Zn 气泡产生 Zn+H2SO4=ZnSO4+H2↑ ②③
【解析】
(1)根据原电池的构成条件及工作原理回答;
(1)根据原电池的工作原理可知,活泼金属做负极,所以该原电池中Zn做负极,Cu做正极;根据化学反应原理可知Zn+H2SO4=ZnSO4+H2↑,所以Cu电极有气泡产生;答案:Zn;气泡产生。
(2)根据化学反应原理可知相应原电池的总反应方程式为:Zn+H2SO4=ZnSO4+H2↑;答案:Zn+H2SO4=ZnSO4+H2↑。
(3)根据原电池的构成条件可知:自发进行的氧化还原反应,2NaOH+H2SO4=Na2SO4+2H2O不属于氧化还原反应,故①不能;②Cu+2Fe3+=Cu2++2Fe2+属于自发进行的氧化还原反应,所以②可实现化学能直接转化为电能;③C2H5OH+3O2![]() 2CO2+3H2O属于自发进行的氧化还原反应,所以③可实现化学能直接转化为电能;答案:②③。
2CO2+3H2O属于自发进行的氧化还原反应,所以③可实现化学能直接转化为电能;答案:②③。


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
【题目】为严厉打击食品生产经营中违法添加非食用物质、滥用食品添加剂,卫生部、农业部等部门联合公布了包含硫酸亚铁在内的22种“易滥用食品添加剂”名单。某同学为探究富含硫酸亚铁且保存时间较长的食品情况,设计了如下实验方案:
![]()
(1)试剂1的主要成分的化学式是________。
(2)加入新制氯水后溶液红色加深的原因是_____________(用离子方程式表示)。
(3)该同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现对褪色原因进行探究。
①提出假设
假设1:溶液中的+3价铁被氧化为更高价态的铁;
假设2:___________。
②设计方案
为了对你所提出的假设2进行验证,请写出一种实验方案:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向一定体积的0.1mol·L-1的Na2CO3溶液中逐滴加入0.1mol·L-1盐酸至过量,溶液中含碳元素的各微粒的物质的量浓度的百分含量随溶液pH的变化如图所示(CO2因逸出未画出,滴加盐酸的过程中温度的变化忽略不计)。下列说法正确的是
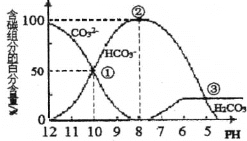
A. 由图可知,碳酸的-lgKa2=10
B. 点②所示溶液中:c(HCO3-)=0.1mol·L-1
C. 当滴加盐酸到点③时,才开始放出CO2气体
D. Na2CO3第一步水解反应的平衡常数:①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12,下列说法正确的是( )
A. 向含有浓度均为0.010 mol·L-1的Cl-和Br-溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,先产生沉淀的离子为Cl-
B. 向饱和AgCl水溶液中加入浓盐酸,Ksp值变大
C. 向AgCl悬浊液中加入足量KBr溶液,沉淀将由白色转化为淡黄色
D. 由方程式:Ag2CrO4(s)![]() 2Ag+(aq)+CrO42-(aq),可推知Ag2CrO4的饱和溶液一定有2c(Ag+)=c(CrO42-)
2Ag+(aq)+CrO42-(aq),可推知Ag2CrO4的饱和溶液一定有2c(Ag+)=c(CrO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硫酸铜晶体结晶水含量测定的实验中,会造成实验结果偏低的是( )
A. 加热时间过长,固体部分变黑B. 坩埚内附有不挥发杂质
C. 晶体不纯,含有不挥发杂质D. 加热过程中有少量晶体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下为中学化学中常见的物质:①Cu; ②FeCl3溶液; ③CuCl2溶液;④CO2;⑤H2SO4;⑥酒精;⑦CaCO3;⑧FeSO4;⑨Ba(OH)2。
请根据要求回答下列有关问题:
(1)以上物质中属于电解质的是________;属于非电解质的是__________。(填序号)
(2)将②③⑧混合配制成浓度均为1molL﹣1的混合溶液100mL,加入一定量的铁粉,充分反应后,若铁粉无剩余,且有铜生成.则反应后的溶液中一定含有的阳离子是______,发生反应的离子方程式为_____________________________________________________。
(3)检验②溶液中阳离子的试剂是________________,证明其存在的现象是____________。
(4)向沸水中逐滴滴加1 mol·L-1 FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是________ nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为探究SO2和Fe(NO3)3溶液的反应的实质。设计了如下图所示装置进行实验.
已知:1.0 mol/L的Fe(NO3)3溶液的pH=1。

请回答:
(1)装置A中用于添加浓硫酸的仪器名称为__________________。
(2)实验前鼓入N2的目的是________________________________。
(3)装置B中产生了白色沉淀,其成分是________,说明SO2具有________性。
(4)分析B中产生白色沉淀的原因。
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与NO3-反应;
①若观点1正确,除产生沉淀外,还应观察到的现象是_________________。
②按观点2,装置B中反应的离子方程式是______________________________,
③有人认为,如将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,也可验证观点2是否正确。此时应选择的最佳试剂是(填序号)_____。
A.1 mol/L稀硝酸 |
B.1.5 mol/L Fe(NO3)2溶液 |
C.6.0 mol/L NaNO3溶液和0.2 mol/L盐酸等体积混合的溶液 |
D.3.0 mol/L NaNO3溶液和0.1mol/L硫酸等体积混合的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL K2CO3与KAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系,如图所示。下列说法正确的是

A. a点溶液中:c(HCO3-)+c(H2CO3)+c(H+)=c(OH-)
B. b点所得溶液中阴离子浓度大小顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-)
C. c点溶液中:c(Cl-)+c(HCO3-)+c(H2CO3)+c(CO32-)=1.5 mol·L-1
D. d→e的过程中水的电离程度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知①Na2O2 ②O2 ③HClO ④H2O2 ⑤Cl2 ⑥NaClO ⑦O3七种物质都具有强氧化性。请回答下列问题:
(1)上述物质中互为同素异形体的是_____(填序号,下同)。
(2)含非极性键的共价化合物是_________。
(3)属于离子化合物的有______种。
(4)Na2O2、HClO、H2O2均能用于制备O2。
①HClO在光照条件下分解生成O2和HCl,用电子式表示HCl的形成过程:_________________________。
②写出Na2O2与H2O反应制备O2的化学方程式:____________________________________。
③H2O2在二氧化锰催化作用下可以制备O2。若6.8g H2O2参加反应,则转移电子数目为_________,生成标准状况下O2体积为_______L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com